
2007年2月济南市中区九年级化学试题
(时间90分钟满分100分)
化学是二十一世纪最有用、最有创造力的中心学科!
相对原子质量 H一1 C一12 N一14 O一16 Na一23 Al―27 S一32
Cl一35.5 K一39 Ca一40 Fe一56 Ag一108
一、选择题(本题包括20小题,共40分。每小题只有一个选项符合题意,将各题选出的答案
1.日常生活中的下列变化,属于物理变化的是
A.木柴燃烧 B.冰雪融化 C.钢铁生锈 D.食物变质
2.“羊毛出在羊身上”,羊毛的主要成分是
A.纤维素 B.脂肪 C.蛋白质 D.糖类
3.我国正在倡导建立环境友好型社会。水是生命之源,保护水资源,防止水污染是每个公民和全社会的责任。下列做法有利于防止水污染的是
①工业废水处理达标后再排放
②农业生产中要合理使用农药和化肥
③生活污水处理达标后再排放
④不用含磷洗衣粉
⑤将海水淡化
A.①②④ B.①③④ C.①②⑧④ D.②③④⑤
4.决定元素种类的是原子的
A.质子数 B.中子数
C.质子数和中子数 D.电子数
5.你经常做家庭小实验吗?根据你的经验,你认为下列家庭小实验中不能成功的是
A.用水、白糖、柠檬、纯碱制汽水
B.糖溶于水能证明分子的一些性质
C.鸡蛋放入醋中变成“软蛋”
D.用食盐水除去菜刀表面的铁锈
6.下列对突发事件的处理不正确的是
A.室内着火被困,立即用湿毛巾捂住口鼻,匍匐前进,寻找安全出口
B.发现有人煤气中毒,立即打开门窗、关闭阀门,将中毒人员转移到空气清新处
C.浓碱液溅到皮肤上,立即涂抹稀硫酸
D.运输硫酸的汽车不慎翻入河中,并产生泄漏,可用生石灰处理河水
7.20世纪以来,随着科学技术的迅速发展,人类创造了空前的物质财富。与此同时,能源的过度开发和消耗导致全球性的能源短缺和环境污染。从原料来源和对环境的影响考虑,下列能源中,最具开发前景的能源是
A.太阳能 B.石油 C.煤 D.天然气
8.下列关于化学实验操作的叙述中,正确的是
A.直接将试纸浸入溶液中,测定溶液的pH
B.夹持试管时,将试管夹从试管上部套至下部
C.稀释浓硫酸时,应把浓硫酸慢慢注入盛有水的量筒内
D.用排水法或向上排空气法收集氧气
9.将甲、乙两种金属片分别放入硫酸铜溶液中,甲表面析出金属铜,乙没有明显现象。据此判断,三种金属的金属活动性顺序是
A.甲>铜>乙 B.乙>铜>甲
C.铜>甲>乙 D.甲>乙>铜
10.对于下列生活中常见元素的微粒结构示意图,有关说法正确的是
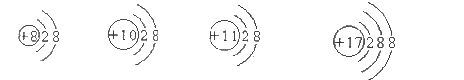
A.它们都表示离子
B.它们都具有相对稳定结构
C.它们的核外电子排布相同
D.前三种表示同一种元素
11.炎热的夏天,小林打开冰箱,从4℃的冷藏室里拿出一杯底部还有少量蔗糖晶体的溶液A,在室温下放置一段时间后,发现晶体消失了,得到溶液B。判断下列说法正确的是
A.蔗糖晶体的溶解度随温度的升高而降低
B.4℃时, A溶液一定是饱和溶液
C.室温下,B溶液一定是饱和溶液
D.A 溶液的溶质质量分数大于B溶液的溶质质量分数
12.下列物质间的转化,不能由一步反应实现的是
A.NaOH→NaCl B.HCI→CaCl2
C.Fe203→Fe(OH)3 D.C02→CaC03
13.下列关于化学反应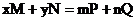 的说法中,正确的是
的说法中,正确的是
A.化学计量数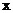 与
与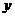 的和一定等于m与n 的和
的和一定等于m与n 的和
B.该反应为复分解反应,且在P和Q中一定有一种物质为水
C.反应物M和N的质量比一定等于生成物P和Q的质量比
D.若M为ag、N为ag,反应后生成的P和Q的质量总和一定不是ag
14.亚硫酸钠(Na2SO3)是一种重要的化工原料,大量用于染料工业。亚硫酸钠中硫元素的化合价是
A.+6 B.+2 C.一2 D.+4
15.生活中有许多宝贵的经验蕴含着化学知识,但也有一些做法是不正确的。请你利用所学的化学知识判断下面的做法中不科学的是
A.新装修的房屋应充分通风后再入住
B.无色透明的塑料袋都可以盛装食品
C.可用汽油洗衣服上的油污
D.用热水配腌蛋的盐水,可加快食盐的溶解速率
16.t℃时,有两瓶硝酸钾溶液,一瓶是饱和溶液(溶质的质量分数为40%),另一瓶是溶质的质量分数为10%的溶液。下列实验操作中,无法区分这两种溶液的是
A.加一定量的水 B.加入少量硝酸钾晶体
C.降低温度 D.t℃时蒸发少量水
17.《环球时报》曾报道:一种名为苹果醋(ACV)的浓缩饮料多年来风靡美国,苹果酸(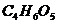 )是其中的主要物质之一。下列说法中错误的是
)是其中的主要物质之一。下列说法中错误的是
A.苹果醋饮料pH<7
B.苹果酸不属于氧化物
C.苹果酸属于无机化合物分类中的酸
D.苹果酸属于有机物
18.欲将下列物质中所含杂质除去,所选除杂试剂正确的是
序号
物质
所含杂质
除杂试剂
①
02
C02
NaOH 溶液
②
CaC03
CaCl2
稀盐酸
③
稀盐酸
稀硫酸
BaCl2溶液
④
KN03溶液
KOH
FeCl3溶液
A.①② B.①⑧ C.②③ D.③④
19.已知反应:A+B→C。若将7gA 和 2gB 或 4gA 和 7gB混合,在一定条件下充分反应后,
均可以得到6gC。若A和B的混合物9g,充分反应后得到7.5gC,则此混合物中A的质量可能是下列数据中的
A.6.5g B.5.5g C.4.5g D.7g
20.甲、乙、丙、丁四种物质之间转化关系如图所示,则物质甲可能是
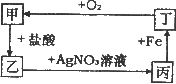
A.Fe203 B.CuO C.Mg D.Cu
二、填空题(本题共8小题,31分)
21.(5分)从H、C、O、Ca 四种元素中,选择适当的元素填写符合下列要求的化学式(各写一个):
(1)煤矿中瓦斯气体的主要成分________;(2)具有还原性的气态氧化物_________;
(3)常用来改良酸性土壤的碱 _________;(4)最常用的溶剂___________;
(5)可用作补钙剂的盐 __________。
22.(2分)今天的午餐你吃的是_______(填写一种食物名称),它为你提供的主要营养素是_________。
23.(4分)美国科学家在银河星系中央的星云中发现了新的星际分子,该分子的化学式为 C3H40。星际分子的不断发现可帮助人们了解生命的起源。请完成下列填空:
(1)该物质是由_____种元素组成,其分子中各原子个数比是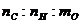 =
__________。
=
__________。
(2)该物质中碳元素的质量分数是 ________(计算结果保留一位小数)。
(3)100g溶质质量分数为46%的酒精溶液(溶质化学式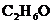 )与____g 该物质中氧元素质量相等。
)与____g 该物质中氧元素质量相等。
24.(9分)(1)写出符合下列要求的化学方程式(各举一例):
①由一种单质和一种化合物参加的非置换反应__________,
②反应前后元素的化合价没有改变的化合反应 __________。
(2)今年入秋以来,我市干旱少雨严重。在必要的情况下,要向空中播撒碘化银微粒,进行人工降雨。请根据碘化银的有关性质,在下表中写出相应的化学方程式及反应类型。
碘化银的性质
反应的化学方程式
反应类型
碘化银(AgI)具有感光性,在光照下可分解为碘单质(I2)和银单质。
碘化银难溶于水,可通过碘化钾溶液和硝酸银溶液反应制得。
复分解反应
25.(1分)鉴别化肥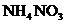 中是否含有
中是否含有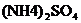 ),加入的物质除水外,还应有____(用化学式表示)。
),加入的物质除水外,还应有____(用化学式表示)。
26;(4分)有一种新型的食品保鲜剂---泡沫铁粉,是将铁粉包裹在多孔泡沫塑料袋里做成的。食品筒里有了它,食品的保存期就大大延长了。请问:
(1)铁粉对食品具有优良保鲜作用的原因是(填序号):________
A.铁是化学性质很稳定的金属
B.铁粉生锈时吸收水分,促使食品保持干燥
C.铁粉生锈时吸收氧气,防止食品发生缓慢氧化
(2)生铁是_______的合金,使用生铁锅炒菜能为人体提供造血所需的微量铁______(填“元素”、“原子”或“分子”),但生铁锅较易生锈,日常生活中防止生铁锅生锈的方法是______________。
27.(3分)不纯的NaCl样品中可能含有KCl、MgCl2、NaNO3中的一种或几种。称取11.7g样品加到水中,得到无色溶液;向其中滴加过量的AgNO3溶液,得到28.7g白色沉淀。则NaCl样品的可能组成有哪些?(填写化学式,有几种情况就填全几种,不一定填满四种情况,写错倒扣分)
第一种情况:NaCl、_________;第二种情况:NaCl、__________;
第三种情况:NaCl、_________;第四种情况:NaCl、__________。
28.(3分)右图是A、B、C三种物质(不含结晶水)的溶解度曲线,请据图回答:

(1)t1℃时,A物质的溶解度为____________;
(2)t2℃时,将A、B、C三种物质的饱和溶液:
①均恒温蒸发等质量的水,析出晶体由多到少的顺序为__________;
②均降温至t1℃时,欲使A和C的溶液中溶质的质量分数相等,则可以采取的一种措施是___________(不需要计算说明)。
三、实验和推断题(本题共3小题,19分)
29.(4分)市场上有一种用于预防和治疗缺氧症状的便携式制氧器,利用过碳酸钾固体A (化学式为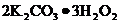 )和黑色固体B(不溶于水)与水混合反应制得氧气。某同学对A、B两种物质进行探究,实验步骤及现象如下图所示:
)和黑色固体B(不溶于水)与水混合反应制得氧气。某同学对A、B两种物质进行探究,实验步骤及现象如下图所示:
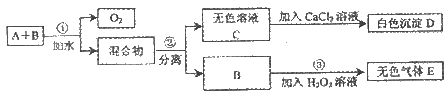
另做实验发现,B在①、③反应前后质量均不变,且可重复使用。
请回答下列问题:
(1)第②步分离混合物的方法是_____________
(2)B在①、③反应中可能是起_____________作用。
(3)写出 D、E两种物质的化学式:D___________,E____________。
30.(7分)A、B、C、D、E为初中化学常见的物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系。请回答:
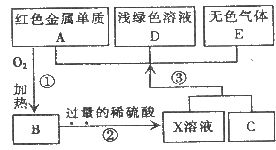
(1)反应①的基本反应类型是__________;其反应的化学方程式__________;
(2)C的化学式为 __________;
(3)写出过程③中生成金属单质A的化学反应方程式 ____________________
(4)右图转化中产生无色气体E的原因是_____________。
31.(8分)纯碱(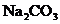 )产品中常含有少量氯化钠。某厂生产的纯碱包装袋上标有“
)产品中常含有少量氯化钠。某厂生产的纯碱包装袋上标有“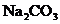 含量≥95%”字样。为判断该产品中
含量≥95%”字样。为判断该产品中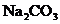 的含量是否达到要求,称取5.0g样品进行检验,可供选取的装置如下图。其中,丙装置中装足量浓氢氧化钠溶液,丁装置中装浓硫酸,戊装置中装水。(提示:浓硫酸具有吸水性,不挥发,不与二氧化碳反应,碳酸钠受热不分解。)
的含量是否达到要求,称取5.0g样品进行检验,可供选取的装置如下图。其中,丙装置中装足量浓氢氧化钠溶液,丁装置中装浓硫酸,戊装置中装水。(提示:浓硫酸具有吸水性,不挥发,不与二氧化碳反应,碳酸钠受热不分解。)
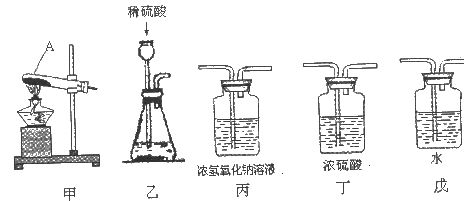
(1)写出上图仪器A的一种常见用途___________。
(2)你选择的实验装置从左到右组装排列为(填编号)___________。请说出你选择或排列装置的一点理由_________。
(3)假设每步都反应完全,生成的二氧化碳全部被吸收,不考虑空气中二氧化碳的影响。较准确地计算“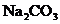 含量≥95%”是否真实,该实验除称取样品质量外,还要用天平量得到的实验数据是 _________。
含量≥95%”是否真实,该实验除称取样品质量外,还要用天平量得到的实验数据是 _________。
(4)若乙装置中加入浓盐酸(有挥发性),对测量结果会产生影响。原因是浓盐酸挥发出的氯化氢气体__________。
(5)若实验装置连接正确,实验过程中看到丙装置出现的气泡比丁少得多,一种可能的原_____________。
四、计算题(本题共2小题,10分)
32.(3分)“禽流感”是一种由病毒引起的传染病,从禽类发病到人类染病引起了全世界的关注。预防这类病毒的方法是消毒,其中NaOH溶液因消毒效果好且廉价易得被广泛使用。某工业烧碱中氢氧化钠的质量分数为80%,一养殖户需配制2000g2%的氢氧化钠溶液对禽舍进行杀菌消毒,需这种工业烧碱_______g。
33.(7分)我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献。工业上用侯氏制碱法制得的纯碱中含有一定量的氯化钠杂质。现称取只含氯化钠杂质的纯碱样品11g,全部溶解在50g水中,当加入稀盐酸64.4g时,恰好完全反应,所得溶液的质量为121g。试求:
(1)该纯碱样品的纯度(计算结果精确到0.1%)。
(2)所得溶液中溶质的质量分数。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com