
2007年德州市禹城区第一次中考练兵考试化学试卷
相对原子质量:C:12 O:16 Na:23 Cl:35.5 K:39 N:14
一、选择题。(每小题2分)
11.下列事实为化学变化的是( )
A.酒精温度计受热酒精柱上升
B.水在自然界中循环
C.把块状的氯化钠粉碎
D.澄清的石灰水长期暴露在空气中出现混浊
12.“信息”、“材料”和“能源”被称为新科技革命的三大支柱,下列叙述不正确的是 ( )
A.核能、太阳能、氢能等是具有广阔开发前景的新能源
B.制造“神州五号”宇宙飞船,使用了大量新型材料
C.有机高分子材料的广泛应用“有百利而无一害”。
D.人类应与环境和谐相处,要合理开发和利用化石燃料等矿物资源
13.固体氢氧化钠和氧化钙的混合物叫做碱石灰,常用作干燥剂,下列气体不能用碱石 灰干燥的是( )
A.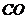 B.
B.
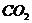 C.
C. D.
D.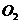
14.“雪碧”是一种无色的碳酸饮料,将少量“雪碧”滴入紫色石蕊试液中,然后再加热, 溶液颜色的变化是( )
A.先变蓝后变紫 B.变红后颜色不再改变
C.先变红色后变红 D.先变红后变紫
15.对下列物质:①纯碱 ②食盐水 ③石灰水 ④烧碱 ⑤液态氧 ⑥氯酸钾,分类全部正确的是( )
A.碱――①④ B.纯净物――③④⑤
C.混合物――②⑤ D.盐――①⑥
16.据《生活报》报道,目前中小学生喜欢使用的涂改液中,含有许多挥发性的有害物 质,长期使用易引起慢性中毒而头晕、头痛,二氯甲烷就是其中的一种,下列关于二氯甲烷(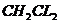 )组成的叙述中,正确的是( )
)组成的叙述中,正确的是( )
A.二氯甲烷是由碳、氢气和氯气组成的
B.二氯甲烷是由碳、氢、氯三种元素组成的
C.二氯甲烷是由一个碳原子、一个氢分子和一个氯分子组成的
D.二氯甲烷是由一个碳原子、两个氢原子和两个氯原子组成的
17.如图,Ⅰ图表示硝酸钾和氢氧化钙的溶解度随温度变化的情况。Ⅱ图中甲、乙试管分别盛有硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体。向烧杯中加入一种物质后,甲试管中的固体减少,乙试管中的固体增加,则加入的物质不可能是( )

A.浓硫酸 B.氢氧化钠 C.氯化钠 D.氧化钙
18.取70g某温度下的氯化钾饱和溶液,将其恒温蒸发10g水,析出4g氯化钾固体,则剩余溶液中所含溶质质量为( )
A.16g B.20g C.40g D.56g
19.在托盘天平的两托盘上各放一只烧杯,分别注入足量的稀盐酸,天平平衡(如图)。向左边烧杯加人10g金属锌.向右边烧杯中加人10g金属镁,当反应停止后,天平指针的指向是( )
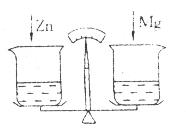
A.分度盘的左边
B.分度盘的中间
C.分度盘的右边
D.三种情况都有可能
第Ⅱ卷(非选择题 共32分)
二、填空题(共16分)
1.某些易碎、易潮的松脆食品,通常在其密封塑料包装袋中充入一种气体,有的还放入一小袋干燥剂。从食品卫生、食品安全和经济角度综合考虑,回答下列问题。
(1)对充入气体的基本要求是__________________。
(2)下列气体中,最适宜用来作充人的气体的是____________(填字母)。
A.空气 B.氮气 C.氧气 D.氦气
(3)下列物质都具有很强的吸水性,最适宜作食品干燥剂的是_____________。(填字母)
A.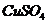 B.浓
B.浓 C.
C.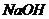 D.
D.

2.某海域由于排入生物所需的营养物质后,水中的营养元素含量过高,导致藻类疯狂生长繁殖。已知藻类的化学式为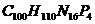
(1)则组成藻类的元素有_________种。
(2)藻类中各元素的原子个数比为__________
(3)工业和生活污水中造成藻类生长过快的营养元素是____________(填元素符号)
3.在使用体温计量体温时,若不慎将体温计打破.散落出来的汞所蒸发出的汞蒸气会对人体造成危害,此时可以撒一些硫粉在上面,使硫与汞发生化合反应,生成固体硫化汞( )
)
(1)写出硫与汞反应的化学方程式_____________________。
(2)用分子、原子的观点解释体温计测量体温时汞柱上升的现象_____________________。
4.下面的表格中列出了氯化铵在不同温度下的溶解度:
温度/℃
0
10
20
30
40
50
60
70
80
溶解度/g
29.4
33.3
37.2
41.4
45.8
50.4
55.2
60.2
65.6
(1)从表格中可得到的一条信息是_______________。
(2)在20℃:时,向100g水中加入50g氯化铵,形成氯化铵的_______(填“饱和”或“不饱和”)溶液,将其温度升高至60℃,溶液的质量为________g,该溶液中溶质与溶剂的质量比为_____。
5.某同学做实验时发现,盛放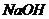 溶液的瓶口与橡皮塞上,常有白色粉末出现。为探究这种白色粉末的成分,设计了如下实验。请你完成实验报告。
溶液的瓶口与橡皮塞上,常有白色粉末出现。为探究这种白色粉末的成分,设计了如下实验。请你完成实验报告。
实验步骤
实验现象
结论和反应的化学方程式
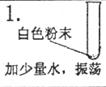
白色粉末溶于水,形成无色溶液
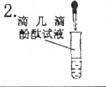
酚酞变红
溶液呈_________性
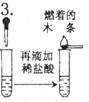
溶液由无色逐渐变为红色,并有气泡产生。产生的气体使燃着的木条熄灭
溶液中含有_______离子;白色粉末中有氢氧化钠变质生成的_______。产生其他的化学方程式为_____________。
三、实验题(共9分)
1.厨房的两个调料瓶中都有些白色固体,只知它们分别是精盐(食盐)和碱面(纯碱)中的一种?请你利用家庭现有的条件,用两种方法把它们区别开来(简要写出步骤、方法、现象和结论)。
(1)_____________________________________________。
(2) _____________________________________________。
2.铬( )是一种重要的金属材料,它具有良好的光泽度和抗腐蚀性,常用来镀在其它金属的表面上,铬同铁、镍组成合金可以制成各种性能的不锈钢。某校化学研究小组对
)是一种重要的金属材料,它具有良好的光泽度和抗腐蚀性,常用来镀在其它金属的表面上,铬同铁、镍组成合金可以制成各种性能的不锈钢。某校化学研究小组对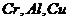 的金属活动性顺序进行探究,过程如下:
的金属活动性顺序进行探究,过程如下:
[作出假设]对三种金属的活动性顺序提出三种可能的假设是:
①Cr>Al>Cu ②Al>Cr>Cu ③Al>Cu>Cr
[查阅资料]你认为该研究小组必需查阅的资料是__________(填编号)
①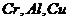 三种金属的密度
三种金属的密度
②Cr能否与酸反应
③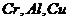 三种金属的导电性。
三种金属的导电性。
[设计实验]同温下,取大小相同的这三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,观察现象。
[控制实验条件]三种金属加入盐酸前都先用砂布将其表面擦光亮,其目的是( )
A.除去氧化膜,利用直接反应
B.使表面光亮,易观察现象
C.使金属温度相同,易反应
[记录现象]
金属
Cr
Al
Cu
与盐酸反应现象
气泡产生缓慢,金
属逐渐溶解
气泡产生激烈,金
属迅速溶解
无气泡产生,金属
无变化
[得出结论]原假设中正确的是_________(填“①”“②”或“③”)。写出铬(+2价)与盐酸反应的化学方程式______________。
(1)根据探究结果,请你预测铬与硫酸铜溶液__________(填“能”或“不能”)反应,理由是_______________。
(2)铝的化学性质比较活泼,在空气中比铁更容易被氧化,但铝制品更耐用,是因为铝制品表面有一层致密的氧化铝保护膜.阻止铝进一步被氧化。食醋不宜用铝制品盛放,其原因是_________________。
四、计算题
l.某研究性学习小组,为了测定纯碱(假定只含氯化钠杂质)中碳酸钠的质量分数,称取纯碱固体1l.2g,将其加入到50g稀盐酸中,恰好完全反应,使气体全部放出,得到氯化钠溶液56.8g。
请你计算:
(1)反应中产生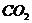 的质量。
的质量。
(2)纯碱中碳酸钠的质量分数。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com