
2006-2007学年度淄博市淄川区初三第二学期期中考试化学
相对原子质量: ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,
第Ⅰ卷选择题(共40分)
一.选择题(每小题2分,共40分。每题只有一个正确答案,将其标号涂到答题卡上)
1.生活中的下列变化,不属于化学变化的是( )
A.面团发酵 B.酒精挥发
C.水果腐烂 D.蜡烛燃烧
2.下列关于溶液的说法中,正确的是( )
A.溶液一定是无色透明的
B.溶液一定是有色的
C.溶液是均一稳定的混合物
D.凡是均一稳定的液体都是溶液
3.保持水的化学性质的粒子是( )
A.氢分子 B.氢原子和氧原子 C.氧分子 D.水分子
4.下列说法正确的是( )
A.空气中氮气的质量分数是78%
B.空气是内几种单质和几种化合物组成的混合物
C.空气中二氧化碳的含量始终不变
D.空气是山几种元素混合而成的化合物
5.水可以造福人类,但水被污染就会给人类造成灾难,为了防止水的污染,下面各项中可以采用的方法是( )
A.生活污水经过净化处理后再排放
B.制止水中所有动植物的生长
C.任意排放工业废水
D.禁止使用农药和化肥
6.对质量守恒定律的正确理解是( )
A.参加反应的各种物质的质量不变
B.化学反应前后各物质的质量不变
C.化学反应前的各物质质量总和等于反应后生成的各物质质量总和
D.参加化学反应的各物质质量总和与反应后生成的各物质质量总和相等
7.关于“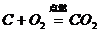 ”正确的叙述是( )
”正确的叙述是( )
A.碳加氧气等于二氧化碳
B.碳加氧气生成二氧化碳
C.碳和氧气在点燃的条件下生成二氧化碳
D.二氧化碳是反应物,碳和氧气是生成物
8.根据质量守恒定律可知反应: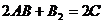 中
中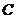 的化学式为( )
的化学式为( )
A.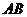 B.
B.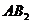 C.
C.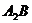 D.
D.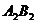
9.某学生用托盘天平称量药品时,将药品与砝码位置放颠倒了,天平平衡后,这个学生称得药品13.5g(1g以下用游码),则药品的实际质量为( )
A.13.5g B.13g C.14g D.12.5g
10.下列化学方程式书写正确的是( )
A、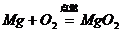
B、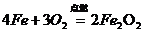
C、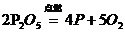
D、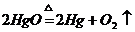
11.下列叙述正确的是 ( )
A.5g镁与3g氧气反应可生成8g氧化镁
B.4g镁与4g氧气反应可生成8g氧化镁
C.4.8g镁与3.2g氧气反应可生成8g氧化镁
D.6g镁与4g氧气反应可生成10g氧化镁
12.自从非典型肺炎在我国部分地区发现以来,一些医用消毒剂走进了百姓之家,如过氧乙酸,双氧水,“84”消毒液等。其中,“84”消毒液的有效成分是次氯酸钠,化学式为NaClO.那么,次氯酸钠中氯元素的化合价为( )
A.-1 B.+1 C.+3 D.+5
13.环境科学家的最新观点是“室内污染不比户外污染轻”。室内装潢所用油漆、胶合板等材料会释放出有害气体,其主要成分是甲醛(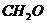 )。下列关于甲醛盼说法正确的是 ( )
)。下列关于甲醛盼说法正确的是 ( )
A。甲醛的相对分子质量为(12+l+16)
B.甲醛分子是由一个碳原子和一个水分子构成
C.甲醛由碳、氢、氧三种元素组成
D.甲醛中碳、氢、氧元素的质量比为1:2:1
14.如图所示形象地表示某反应前后反应物与生成物分子及其数目的变化,其中 分别表示A、B、C三种不同的分子,该反应的化学方程式中A、B、C前后的化学计量数之比为:( )
分别表示A、B、C三种不同的分子,该反应的化学方程式中A、B、C前后的化学计量数之比为:( )
A.4:l:3 B.3:1:2
C.4:1:2 D.3:1:3

15.在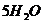 和
和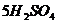 中,含有相同的( )
中,含有相同的( )
A.氢元素的数目 B.氢分子的数目
C.氢原子的数目 D.氢气的数目
16.镁带在耐高温的容器中密封(内含空气)加热,下图中能正确表示容器中所盛物质总质量变化情况的是( )

17.氢气和氧气的混合气体12g,点燃充分反应后,还剩余了3g氢气,则混合气体中含有氢气的质量是( )
A.4g B.5g C.6g D.7g
18.黑火药是我国古代四大发明之一。黑火药爆炸的原理可以用下式表示: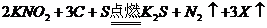 ,根据质量守恒定律推断X化学式为(
)
,根据质量守恒定律推断X化学式为(
)
A.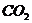 B.
B.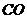 C.
C.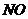 D.
D.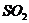
19、某纯净物在空气中燃烧生成了水和二氧化碳两种物质。实验测得1.6g该纯净物在空气中燃烧后,生成了4.4g二氧化碳和3.6g水,则该纯净物的组成为( )
A.只含有碳、氢元素
B.含有碳、氢、氧元素
C.肯定含有碳、氢元素,可能含有氧元素
D.无法判断
20.在一密闭容器内有四种物质,在一定条件下充分反应后,测得反应前后各物质的质量
如下:
物质
X
Y
Z
Q
反应前质量/g
4
10
l
21
反应后质量/g
0
12
15
待测
已知X的相对分子质量为n,Q的相对分子质量为2n,下列推理正确的是( )
A.反应后Q的质量为12g
B.反应后生成15gz
C.反应中Y与Q发生改变的质之比为l:1
D.该反应方程中,X与Q的化学计量数之比为2:3
第Ⅱ卷 非选择题(共60分)
二.理解与应用(本题共36分)
21.空气中含量最多的气体是(填化学式,下同)_____,能使可燃物燃烧更旺的气体是_____,使澄清石灰水变混浊的气体是_____,食品包装袋内充入的防腐气体是_____。目前计入空气污染指数的项目暂定为(填化学式) _____、_____、_____可吸入颗粒物等;污染指数大,说明空气质量状况____________________。
22.已知下列元素或原子团的化合价,请按照示例要求,写出它们之间形成化合物的化学式。(这些化合物都是存在并且常见的物质)
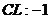
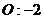
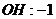
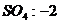
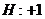
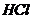
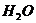
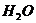
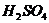
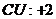
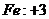
23.化学方程式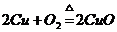 的表示涵义是:
的表示涵义是:
(1) _________________________;
(2) _________________________.
24、对知识归纳和整理是学习化学的一种重要方法。现有三个化学反应如下:
①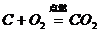 ②
②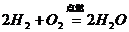 ③
③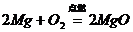
通过比较可以发现它们有许多相似之处,
其一是_________________________;
其二是_________________________;
请你写出另一个符合这两点的化学方程式:_________________________。
25.将16g硫在给定氧气的质量15g、16g、20g,生成二氧化硫的质量30g、32g、32g,回答下列问题:
(1)以上数据说明,在三次实验中第__________次恰好完全反应.
(2)第_____次实验中硫有剩余,剩余_____g.
(3)第_____次实验中氧气有剩余,剩余_____g.
26.现有氢气、水、过氧化氢、二氧化锰、氧化汞、氧气六种物质,从中选择适当的物质,按下列要求进行反应,写出反应的化学方程式。
(1)有水生成的化合反应:__________;
(2)有气体生成的分解反应:__________;
(3)有金属单质生成的分解反应:__________.
三、实验与探究(本题共14分)
27.如图所示是测定自磷燃烧前后质量变化情况的实验,用来验证质量守恒定律。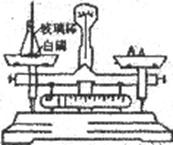
(1)白磷燃烧时观察到的现象是_________________________。
写出该反应的化学方程式:________________________。
(2)左盘锥形瓶口在自磷点燃反应并冷却后为什么还要塞紧瓶塞__________。
(3)点燃时,若瓶塞未塞紧,待燃烧完毕后再塞紧,天平的指针将会__________。(填“偏左”、“偏右”、“正中”)理由是_________________________。
28.为研究化学反应前后反应物与生成物之间的质量关系,三位同学分别做了如下三个实验:
实验一:称量镁条,点燃,待反应结束后,再称量;
实验二;将盛有稀盐酸的小试管放入装有石灰石颗粒的烧杯中,称量,然后将盐酸与石灰石接触,充分反应后再称量;
实验三:将盛有氢氧化钠溶液的试管放入盛有硫酸铜溶液的烧杯中,称量,然后设法使两种溶液混合,充分反应后再称量。
三位同学得到的实验数据如下表:
编号
实验一
实验二
实验三
反应前
4.8 g
112.6 g
118.4 g
反应后
8.0 g
112.4 g
118.4 g
(1)从表面上看,这三个实验中,发生化学反应前后物质的质量(填“增大”,“减小”或“不变”):实验一_____,实验二_____,实验三_____.
(2)造成上述结果的原因可能是____________________.
四、分析与计算(共10分)
29.(4分)硝酸铵是一种常见化肥,又是一种烈性炸药。
下面是某一厂家生产的硝酸铵化肥袋上的部分文字:
产品名称:硝酸铵
化学式: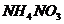
含氮量:约34.3%
注意事项:防撞击
其它:………
根据化肥袋上提供的信息,试计算:
(1)硝酸铵中,氨元素的化合价有___________;
(2)硝酸铵的相对分子质量为_______________;
(3)纯净硝酸铵中氮元素的质量分数为 ______;
(4)该化肥中硝酸铵的质量分数为___________。
30.工业上,高温煅烧石灰石(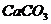 )可制取生石灰(
)可制取生石灰(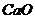 )和二氧化碳。如果要制取4.4kg二氧化碳,若用含杂质20%的石灰石来制取,需要这种石灰石多少千克?
)和二氧化碳。如果要制取4.4kg二氧化碳,若用含杂质20%的石灰石来制取,需要这种石灰石多少千克?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com