
2008年江苏省宿迁市初中毕业暨升学考试
物理?化学试卷化学部分
本试卷分第一卷(选择题)和第二卷(非选择题)两部分。
可能用到的相对原子质量: H-1 He-4 C-12 O-16 Na-23 Mg-24 Al-27 Cl-35.5 Cu-64
第一卷 (选择题 共52分)
一、选择题(本大题共26小题,每小题的四个选项中,只有一个选项符合题意.)
15.今年8月,第29届夏季奥运会将在我国北京举办.为了有效防止汽车尾气污染,北京市汽车燃料的使用正在逐渐用新的清洁燃料取代目前的汽油,下列燃料中:①煤 ②天然气 ③乙醇 ④一氧化碳,属于较清洁燃料的是
A. ①②③ B.①③④ C.②④ D. ②③
16.夏日里想随时喝到凉爽的饮料,可以自制化学“冰箱”,即把一种化学试剂放入一定量的水中,就可以形成一种低温小环境.这种试剂可以是下列物质中的
A.食盐 B.蔗糖 C.硝酸铵 D.熟石灰
17.小明对所学知识进行归纳,其中有错误的一组是
A.常见干燥剂:石灰石、浓硫酸、生石灰
B.常见的合金:不锈钢、焊锡、生铁
C.常见营养物质:蛋白质、无机盐、维生素
D.常见的材料:金属材料、硅酸盐材料、有机高分子材料
18.下列化学用语与含义相符的是
A. ――1个镁离子带2个单位正电荷 B.Mn2+――锰元素的化合价为+2价
――1个镁离子带2个单位正电荷 B.Mn2+――锰元素的化合价为+2价
C.2N――1个氮分子由2个氮原子构成 D.2NO2――2个二氧化氮分子
19.诗句“春蚕到死丝方尽,蜡炬成灰泪始干”常用来比喻老师无私奉献精神,其中也蕴含着很多化学含义.下列说法中不正确的是
A.诗句中涉及了化学变化
B.诗句中的“丝”含有的物质是纤维素
C.诗句中的“灰”指的是蜡烛燃烧产生的CO2等气体和炭粒
D.诗句中的“泪”指的是液态石蜡
20.下列说法正确的是
A.验证NaOH溶液中是否含有SO42-,先加入稀硫酸,再加入BaCl2溶液,有白色沉淀,证明含有SO42-
B.测定溶液的pH,先用水润湿pH试纸,然后将试纸插入待测液中
C.向某无色溶液中滴入酚酞试液呈红色,说明该溶液一定是碱溶液
D.点燃可燃性气体时,要先检验气体纯度,后点燃
21.下列离子能在pH=2的无色溶液中大量共存的是
A.SO42-、Fe3+、Na+、OH- B. K+、SO42-、Cu2+、NO3-
C.Cl-、K+、SO42-、Na+ D. Ca2+、Cl-、CO32-、Na+
22.下列日常生活中的做法可行的是
①大豆、花生和谷物被霉菌污染后,人不可食用,但可喂养家禽
②由于淀粉有遇碘变蓝的特性,可利用淀粉检验加碘食盐的真假
③喝牛奶、豆浆等富含蛋白质的食品可有效缓解重金属盐中毒现象
④低血糖病症发作时,吃馒头要比喝葡萄糖水见效快
⑤患有夜盲症的病人,多食用动物肝脏有利于视力恢复
A. ①③④ B. ②④ C. ②③⑤ D. ③⑤
23.法国科学家发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”.它与天体中的中子星构成类似。有关该粒子的说法不正确的是
A. 不显电性 B. 相当于一个氦原子的质量
C. 失去一个中子后显+1价 D.周期表中没有该“元素”的位置
24.根据图中所示的溶解度曲线,判断下列说法中不正确的是
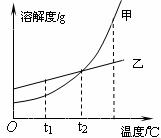
A.t
B.t
C.将t
D.当甲物质中混有少量乙物质时,可采用冷却热饱和溶液的方法提纯甲
25.痕检是公安机关提取犯罪嫌疑人指纹的一种重要方法,AgNO3显现法就是其中的一种。如果将物质①的溶液小心地涂到指纹上,①就跟汗渍中的物质②作用生成物质③,物质③在光照下分解出灰褐色银粒,随着银粒增多,最终变成黑色的“指纹线”.则物质①、②、③的化学式是[已知:AgX(X代表Cl、Br、I)性质相似,见光易分解2AgX=2Ag +X2]
A.①AgNO3 ②NaCl ③AgCl B.①AgNO3 ②NaBr ③AgBr
C.①AgCl ②AgNO3 ③NaCl D.①AgNO3 ②NaI ③AgI
26.下图是某兴趣小组设计的四个实验装置,其中实验能够成功的是
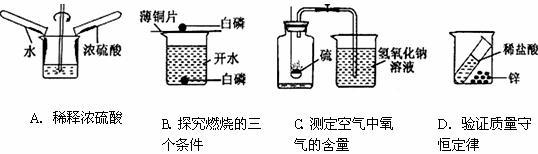
第二卷(非选择题)
化学部分(36分)
五、实验与探究(本大题包括2小题,共18分)
36.(9分)由于大量使用一次性塑料方便袋而造成的“白色污染”已成为一个严重的社会问题。某化学研究小组的同学对某种塑料袋的组成进行分析研究(资料显示该塑料只含C、H两种元素)。他们设计了如图所示的实验装置,使该塑料试样在纯氧中完全燃烧,观察实验现象、分析有关数据、推算元素含量。
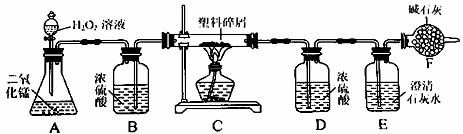
(1)实验装置中有一处明显错误,请写出改正方法 .
(2)装置A中反应的化学方程式为 .
(3)装置E中的现象是 ,装置F的作用是
(4)若装置C的玻璃管中放入的塑料试样质量为5.9g,塑料试样充分燃烧后,装置D增重7.2g,则该塑料试样中含氢元素的质量为 g;假设塑料的组成为CxHy,则装置C的玻璃管中反应的化学方程式为 (化学计量数用含x、y的代数式表示,且可以是分数)
(5)若装置中没有连接装置B,将使该塑料试样中氢元素的质量测算结果 ( 填“偏小”、“ 偏大”或“无影响” )
37.(9分)有一种工业废水,其中含有大量的硫酸亚铁,少量的银离子以及污泥。某同学设计了一个既经济又合理的方法回收银和硫酸亚铁晶体。方案流程如下:

回答下列问题:
(1)步骤②中:需加入的物质是 ,分离所得混合物的方法是 。
(2)步骤③中:需加入的物质是 ,发生反应的化学方程式是 。
(3)某同学认为经过步骤②后所得固体就是纯净的银,不需要进行步骤③,你认为是否合理? ,理由是 .
(4)步骤④的操作是 ,溶液2和溶液3为什么要混合? .
六、推理与计算(本大题包括2小题,共18分)
38.(8分)已知有如下反应:A+B→C+D.(答题时需注明必要的反应条件)
(1)若A为Al、B为ZnSO4(溶液),C、D的化学式分别是 、
(2)若A为Fe2O3,写出一个可能的化学方程式
(3)若A为CO2、B为H2O,则该反应的化学方程式是 .
(4)若反应为A+2NaOH =C+Cu(OH)2↓,则A和C的相对分子质量之差为 .
39.(10分)我国化学家侯德榜发明了一种著名的纯碱生产方法----“联合制碱法”.
(1)“联合制碱法”生产过程用化学方程式可简要表示为:
①NH3+CO2+H2O=NH4HCO3
②NH4HCO3+NaCl=NaHCO3↓+NH4Cl
③2NaHCO3 = Na2CO3+H2O+CO2↑
该过程中没有涉及的基本反应类型是
(2) 第②步中加入的是磨细食盐粉,食盐磨细的目的___________ ;
从该步反应还可以获得 肥
(3)上述方法制得的纯碱产品中常含有少量的氯化钠。某研究性学习小组对刚生产出的纯碱产品进行检测。取
首先发生的反应是:Na2CO3+HCl=NaHCO3+NaCl;
然后发生的反应是:NaHCO3+HCl= NaCl+H2O+CO2↑.
在上述过程中烧杯中溶液质量与加入稀盐酸质量的关系如图甲所示.
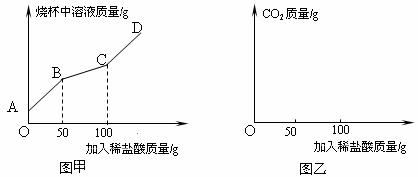
①请你根据图甲提供的信息,在图乙的坐标系中画出检测过程中产生CO2的质量随滴加盐酸质量的变化曲线。(标明二氧化碳质量的相应数值)
②计算该样品中纯碱的质量分数。(计算结果用百分数表示,保留到小数点后一位)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com