
2008年南通市初中毕业、升学考试
化学试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共100分。考试时间100分钟。考试结束,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-
第Ⅰ卷(选择题 共40分)
一、选择题(本题共15小题,每小题2分,共30分)每小题给出的四个选项中只有一个选项正确,请将正确选项的序号填涂在答题卡上。
1.北京奥运火炬的外壳主要采用高品质的铝合金材料制造,燃烧系统内装环保型燃料――丙烷(C3H8)。下列说法正确的是
A.铝合金制作的火炬质量轻、不易腐蚀 B.铝合金硬度小、不易导热
C.丙烷分子中C、H电子数之比为3∶8 D.丙烷在常温常压下是固体
2.把少量物质分别加入到另一物质中,充分搅拌,可以得到溶液的是
A.碘加入汽油中 B.面粉加入水中
C.高锰酸钾加入汽油中 D.植物油加入水中
3.分类是学习和研究化学物质的一种常用的科学方法,下列分类正确的是
A.碳酸氢钠能解离出H+,属于酸
B.一氧化碳中含有碳元素,属于有机物
C.氢氧化钠中含有氧元素,属于氧化物
D.绿矾可用化学式FeSO4?7H2O表示,属于纯净物
4.要使一杯氯化铵不饱和溶液变为饱和溶液,可采取的方法是
A.加水 B.不断搅拌
C.升高温度 D.加氯化铵晶体
5.下列有关水的叙述中,不正确的是
A.水汽化时分子间隔发生了变化 B.用明矾溶液可以区分硬水和软水
C.工业废水处理后可以循环使用 D.水是能溶解多种物质的常用溶剂
6.古语道:“人要实,火要虚”。此话的意思是说:做人必须脚踏实地,事业才能有成;燃烧固体燃料需要架空,燃烧才能更旺。从燃烧的条件看,“火要虚”的实质是
A.增大可燃物的热值 B.提高空气中氧气的含量
C.提高可燃物的着火点 D.增大可燃物与空气的接触面积
7.下列关于分子、原子、离子构成物质的说法中,不正确的是
A.汞原子聚集成金属汞
B.氢原子结合成氢气
C.氯原子和氢原子结合成氯化氢分子,氯化氢分子聚集成氯化氢
D.氯原子和钠原子得失电子形成氯离子和钠离子,两种离子结合成氯化钠
8.对有关实验现象的描述正确的是
A.碳在氧气中燃烧放出白烟 B.干冰在空气中升华周围出现白雾
C.铁丝在氧气中燃烧生成四氧化三铁 D.硫在氧气中燃烧发出淡蓝色的火焰
9.若金属锰(Mn)在金属活动性顺序中位于铝和锌之间,则下列反应不正确的是
A.Mn + H2SO4 = MnSO4 + H2↑ B.Mg + MnSO4 = MgSO4 + Mn
C.Fe + MnSO4 = FeSO4 + Mn D.Mn + CuSO4 = MnSO4 + Cu
10.下图是金刚石、石墨、C60、碳纳米管结构示意图,下列说法正确的是
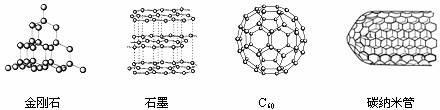
A.这四种物质都很软,可作润滑剂
B.这四种物质碳原子的排列方式相同
C.这四种物质完全燃烧后的产物都是CO2
D.这四种物质的结构中都是每个碳原子连接3个碳原子
11.下列制取气体的方案,可以直接采用下图所示装置进行的是
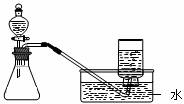
①用H2O2和MnO2制取O2
②用CaCO3和稀盐酸制取CO2
③用KClO3和MnO2制取O2
④用Zn和稀H2SO4制取H2
⑤用Na2CO3和H2SO4制取CO2
A.①④ B.①②④
C.①②⑤ D.①②④⑤
12.利用下列原理制取氧气,具有反应快、操作简便、能耗少、无污染的是
A.2 KClO3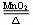 2 KCl + 3 O2↑
B.2 KMnO4
2 KCl + 3 O2↑
B.2 KMnO4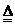 K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
C.2 H2O2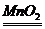 2 H2O + O2↑
D.2 HgO
2 H2O + O2↑
D.2 HgO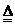 2 Hg + O2↑
2 Hg + O2↑
13.下列物质的转化能实现的是
A.H2SO4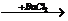 HCl
B.CO
HCl
B.CO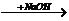 Na2CO3
Na2CO3
C.Cu(OH)2 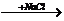 NaOH D.NaNO3
NaOH D.NaNO3 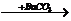 Ba(NO3)2
Ba(NO3)2
14.下列说法不正确的是
A.碳酸氢钠可以用来治疗胃酸过多
B.氨水(NH3?H2O)涂在蚊虫叮咬后的皮肤上,可减轻痛痒
C.通过大量使用农药,防治病虫害,以提高产量,符合可持续发展
D.汽油中加入适量乙醇作为汽车燃料,可节省石油资源、减少污染
15.氮肥、磷肥、钾肥是农业生产中最主要的化肥,用简便方法区别三种化肥,在农业生产中具有实用性。区别下列相关化肥的方法可行的是
A.NH4Cl与KCl:观察外观
B.NH4HCO3与KCl:加水
C.K2SO4与Ca3(PO4)2:闻气味
D.(NH4)2SO4与K2SO4:加熟石灰研磨后闻气味
二、选择题(本题共5小题,每小题2分,共10分)每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给2分,但只要选错一个,该小题就为0分。请将正确选项的序号填涂在答题卡上。
16.有关2 CuO + C 2 Cu + CO2↑的反应,说法正确的是
2 Cu + CO2↑的反应,说法正确的是
A.CuO具有氧化性 B.C发生了还原反应
C.反应前后氧元素的化合价没有改变 D.反应前后固体质量不变
17.在生活、生产和科学研究中,常用pH试纸测定溶液的pH。以下测定操作正确是
A.将被测液滴到放在玻璃片上的pH试纸上,显色后,与标准比色卡比较
B.将pH试纸直接投入被测液中,显色后,取出与标准比色卡比较
C.先用少量水湿润试纸,后滴上被测液,显色后,与标准比色卡比较
D.先用蒸馏水清洗滴管,随后吸取被测液滴到试纸上,显色后,与标准比色卡比较
18.下列变化过程中吸收热量的是
A.Zn与盐酸反应 B.NaOH固体溶于水
C.CO2与C反应 D.NH4NO3固体溶于水
19. 除去下列物质中所含少量杂质的方法正确的是
物质
杂质
除杂试剂
提纯方法
A
CO2
CO
O2
点燃
B
KCl
MnO2
水
溶解、过滤、蒸发
C
H2O
NaNO2
活性炭
吸附、过滤
D
Na2CO3
Na2SO4
BaCl2
溶解、过滤、洗涤
20. A、B、C三种物质各
A.第一次反应停止后,B剩余
C.反应中A和B的质量比是3∶2 D.反应中A和C的质量比是5∶2
第Ⅱ卷(非选择题 共60分)
三、(本题共4小题,每空1分,共20分)
21.(6分)化学可以帮助人类认识改造周围的世界,促进社会发展。
(1)糖类、油脂、蛋白质和维生素都是人类的基本营养物质。下表为某品牌燕麦片标签中的一部分。
每
营养成分
糖类
油脂
蛋白质
维生素C
钙
镁
钠
锌
7.
7.
7.
18 mg
201 mg
18.2 mg
30.8 mg
8.1 mg
① 燕麦片的营养成分中能与水反应生成氨基酸的营养物质是___________________;每克营养物质氧化时放出能量最多的是__________;人体必需的微量元素是___________。
② 维生素C易溶于水,向其水溶液中滴入紫色石蕊试液,石蕊变红色,加热该溶液至沸腾,红色消失。因此,烹调富含维生素C的食物时,应该注意_____________;在碱性条件下,维生素C易被空气氧化,烧煮时最好加一点________。
(2)我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等。用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:
纤维编号
①
②
③
灼烧时的气味
特殊气味
烧纸气味
烧焦羽毛气味
则羊毛、棉花的编号分别为_________________________。
22.(4分)
(1)元素X的离子结构示意图为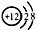 ,元素 Y的原子结构示意图为
,元素 Y的原子结构示意图为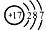 。写出X的离子符号_____________;X与Y形成化合物的化学式为_____________。
。写出X的离子符号_____________;X与Y形成化合物的化学式为_____________。
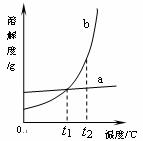
(2) a、b两种固体物质的溶解度曲线如下图所示。在______℃时a、b的溶质质量分数相等。当a的饱和溶液含有少量b时,通过_________________提纯a。
23.(4分)1909年化学家哈伯在实验室首次合成了氨。2007年化学家格哈德?埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得诺贝尔化学奖。
(1)将氢气和氮气在高温、高压和催化剂的条件下合成氨(NH3)。反应的化学方程式为_____________________________________________________。
(2)用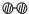 、
、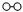 、
、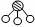 分别表示N2、H2、NH3。观察下图,写出符合在催化剂表面合成氨反应过程的顺序________________________(将下面五张图按反应过程顺序用序号排列)。
分别表示N2、H2、NH3。观察下图,写出符合在催化剂表面合成氨反应过程的顺序________________________(将下面五张图按反应过程顺序用序号排列)。
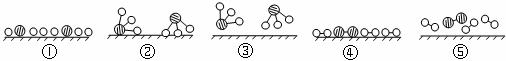
(3)表面化学对于化学工业很重要,它可以帮助我们了解不同的过程。在潮湿的空气里,铁表面吸附了一层薄薄的水膜,同时由于空气中O2的溶解,水膜呈中性。若空气中CO2溶解,水膜呈酸性,写出该反应的化学方程式______________________。
在汽车排气管上安装尾气净化装置,可使尾气中的CO和NO在催化剂表面发生反应,产生两种空气组成的气体,写出该反应的化学方程式________________________________。
24.(6分)下图中A、B、C、D、E、F、G、H分别代表相关反应的一种物质。已知:X、H为黑色固体单质,D是大理石的主要成分,Y为红棕色粉末。常温下C、E、F、G均为无色气体,图中有部分生成物未标出。请填写以下空白:
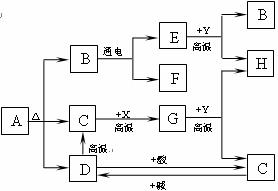
(1)写出下列两种物质的化学式: E_____________,X______________。
(2)写出下列反应的化学方程式:
① D C的反应:_____________________________________________。
C的反应:_____________________________________________。
② C D的反应:_____________________________________________。
D的反应:_____________________________________________。
③ F与H的反应:__________________________________________________。
④ G与Y的反应:__________________________________________________。
四、(本题1小题,每空1分,共10分)
25.(10分)“嫦娥一号”卫星发射成功,标志月球探测成为中国航天的现实。
(1)“嫦娥一号”使用的燃料是液氢,助燃剂是液氧。氧气从淡蓝色液体变成无色气体发生了_______变化,氢气燃烧的化学方程式为___________________。液态氢作燃料除燃烧时产生较大的推动力外,另一个优点是_____________。对于目前全世界出现能源危机,以及燃烧对环境的影响,我们应该合理开发利用的新能源有(至少填两种)___________________。
(2)月球上的3He(3表示相对原子质量)蕴藏量巨大,探月的目标之一是探测核聚变燃料3He的分布。地球上的氦元素主要以4He形式存在。从原子的构成来看,3He、4He两种原子的_______数不同,化学性质_______________。
(3)“嫦娥一号”另一个目标是探测下列14种元素的含量和分布:K、Th(钍)、U(铀)、O、Si、Mg、Al、Ca、Fe、Ti(钛)、Na、Mn、Cr(铬)、Gd(钆)。其中属于金属元素的有 种。
(4)月球表面富含钛铁矿,钛因其硬度大、熔点高、常温下耐酸碱、耐腐蚀等优良的性能,被誉为“未来金属”。我国四川省有大型钒钛磁铁矿,由钒钛磁铁矿提取金属钛的主要工艺过程如下:
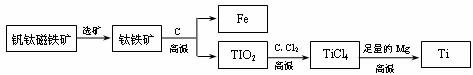
①钛铁矿的主要成分是FeTiO3(钛酸亚铁),其中钛的化合价为 价。
②TiCl4在高温下与足量Mg反应生成金属Ti,该反应属于_____________(填反应类型)。
③上述生产过程中得到的金属钛中混有少量金属杂质,可加入_________________除去。
五、(本题共3小题,每空1分,共21分)
26.(4分)规范的实验操作是实验成功的前提,请回答:
(1)量取8mL稀硫酸,应选用______________mL的量筒。
(2)胶头滴管用过后应____________,再去吸取其他药品。
(3)实验室用烧瓶制取蒸馏水时,烧瓶的底部应垫放______________。
(4)玻璃管插入带孔橡皮塞,先把玻璃管的一段______________,然后稍稍用力转动插入。
27.(8分)已知某纯碱试样中含有杂质氯化钠,为测定试样中纯碱的质量分数,可用下图装置进行实验。
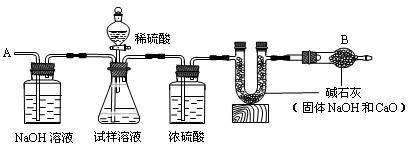
主要步骤如下,请填空:
①
按图组装仪器,并检查__________________;② 将
回答下列问题:
(1)装置中浓硫酸的作用是___________________________________。
(2)步骤⑤的目的是_________________________________________。
(3)试样中纯碱的质量分数为_________________________________。
(4)分液漏斗中的稀H2SO4不能换成浓盐酸,理由是______________________________。
(5)若用生成沉淀的方法来测定试样中纯碱的质量分数,应选用的试剂是____________。
28.(9分)请你参与下列探究:
【问题情景】某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多的气泡放出。这一现象激发起同学们的探究欲望,生成的是什么气体?
【提出猜想】从物质组成元素的角度,放出的气体可能是SO2、O2、H2。
【查阅资料】SO2易溶于水,它能与NaOH反应,生成Na2SO3。
【方案设计】依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O2,则检验方法是_____________________________________。
(2)乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量。写出SO2与NaOH反应的化学方程式________________________。
(3)实验小组同学合作设计了如下组合实验方案,排除和验证猜想的气体。
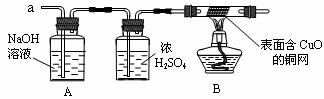
如果放出的是O2和H2,你认为方案中的安全隐患是 。
丙同学认为:为确保安全,实验前应先收集一试管气体,用拇指 ,若不发出________________,方可采用上面的装置进行实验。
【实验探究】经丙同学确认安全后,小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色;停止通气,再次称量装置A,发现质量无增减。
结论:铁粉与硫酸铜溶液反应时,产生的气体是_________________。
【思维拓展】
(1)由上述实验可以推出,硫酸铜溶液中可能含有____________物质。
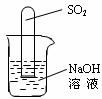
(2)不通过称量,如何判断SO2与NaOH溶液发生了反应呢?有一同学设计了下图所示的装置进行实验,发现试管内液面上升,就得出SO2与NaOH溶液发生反应的结论。其他同学认为这一方案不严谨,理由是_______________________________。要得到科学严谨的结论,仍利用该装置,补做的实验是_____________________________________。
六、(本题共2小题,共9分)
29.(4分)
(1)亚氯酸钠中Na、Cl、O三种元素的质量之比为_____________________________。
(2)现要配制质量分数为16%的亚氯酸钠消毒液
30.(5分)阳光牌小包装“脱氧剂”成分为Fe粉、活性炭及少量NaCl、水。使用一段时间后,其中的Fe粉会转变成Fe2O3而变质。某化学兴趣小组欲探究使用过的阳光牌“脱氧剂”的变质程度(已变质的Fe粉占变质前Fe粉的质量分数),设计并进行如下探究过程。
步骤(1)取食品包装袋中的阳光牌“脱氧剂”一袋,将里面的固体溶于水,过滤、洗涤、干燥滤渣。
步骤(2)取步骤(1)中的滤渣8.
步骤(3)取步骤(2)中的滤液,加入足量的NaOH溶液,得到的固体经洗涤后转移到坩埚中,充分加热、冷却、称量,得到8.
求:(1)8.
(2)该“脱氧剂”在未变质时,Fe粉和活性炭的质量之比。
(3)该“脱氧剂”的变质程度。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com