
2009年4月山东省淄博市周村中考第一次模拟考试
理科综合测试化学部分
相对原子质量:H:
第Ⅰ卷(选择题 共64分)
一、选择题(16―25每题1分,26―30每题2分,共20分。每题只有一个选项符合题意)
16.下列变化中,能说明分子是可以再分的是
A.加热氧化汞得到汞和氧气 B.分离空气制取氧气
C.蒸发食盐水得到食盐 D.硫酸铜晶体研磨成粉末
17.下列关于物质用途的描述不正确的是
A.食盐可用作调味品 B.熟石灰可用于改良碱性土壤
C.干冰可用于人工降雨 D.盐酸可用于金属除锈
18.下列说法不正确的是
A.甲醛、重金属盐都能使蛋白质变性,失去原有的生理功能
B.活性炭可以吸附水中有色、有味的物质
C.二氧化硫、二氧化碳、二氧化氮是污染空气的主要气体
D.电池是将化学能转变成电能的装置
19.人体内含量低于万分之一的20多种元素称为微量元素。这些元素虽然含量很低,但对人体的正常代谢和健康却有着重要作用。下列元素肯定不是人体微量元素的是
A.铁 B.锌 C.碘 D.氯
20.下列实验的最终现象,不能证明分子总是在不断运动着的是

21.推理是化学学习中常用的思维方法。下列推理正确的是
A.酸能使紫色石蕊溶液变红。通入CO2后的紫色石蕊溶液变红,所以CO2是酸
B.酸性溶液的pH小于7。食醋是酸性溶液,所以食醋的pH小于7
C.在同一化合物中,金属元素显正价,所以非金属元素一定显负价
D.溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小
22.豆腐是我国古代的一项重要发明,豆制品被视为中华饮食文化的瑰宝。下图是某豆腐干标签的部分内容,配料中富含蛋白质的是
X X 豆腐干
配料
优质大豆、食盐、植物油、味精、辣椒、山梨酸钾
A.优质大豆 B.食盐 C.植物油 D.辣椒
23.现用质量分数为98%的浓硫酸(密度是
A.配制稀硫酸时,用到的玻璃仪器只需量筒和烧杯
B.配制稀硫酸时,一定不能用天平称量所需浓硫酸的质量
C.将
D.将480mL水倾倒入盛有80 mL98%浓硫酸的500mL量筒中
24.善于梳理化学知识,能使你头脑更聪明。以下完全正确的一组是
A
物质的性质与用途
B
安全常识
N2性质稳定―可作灯泡填充气
乙醇具有可燃性―可作燃料
石墨很软―可作电极
假酒中毒―由甲醛引起
煤矿爆炸―由瓦斯引起
假盐中毒―由NaNO2引起
C
元素与人体健康
D
日常生活经验
缺维生素C―易引起坏血病
缺钙―易骨质疏松或得佝偻病
缺碘―易甲状腺肿大
食品干燥剂―常用CuO
区别硬水与软水―用肥皂水检验
是煤燃烧更旺―把煤作成蜂窝状
25.某班组织了以“环境污染都是化学惹的祸吗?”为主题的辨论赛,正方观点是“环境污染都是化学惹的祸”,反方观点是“环境污染不全是化学惹的祸”。下列各项不能成为反方观点论据的是
A.病菌导致流感 B.汽车鸣笛产生噪音
C.燃放鞭炮形成烟雾 D.电磁辐射引发白血病
26.对“大棚”农作物施用“汽水”(碳酸溶液),是近年来在种植生产中兴起的一种新方法。对于其作用的下列几种叙述:①加速植物光合作用;②冬天有助于农作物“防冻”;③有利于改良碱性土壤,调节pH;④可促进土壤中的Ca2+、Mg2+被植物吸收。其中正确的是
A.①②③ B.②③④ C.①③④ D.全部
27.石蕊、硫酸、氢氧化钙、碳酸钠是常见的四种物质,它们的溶液之间的反应关系如下图所示。图中两圆相交部分(A、B、C、D)表示物质间反应的主要实验现象,其中描述正确的是

A.石蕊溶液变为红色 B.无明显现象
C.生成无色气体 D.石蕊呈紫色
28.煤气中添加少量有特殊臭味的乙硫醇(C2H5SH),可以提醒人们预防煤气泄露。乙硫醇在煤气燃烧过程中也可充分燃烧,其反应方程式为
 4CO2 +
2X + 6H2O, 则X的化学式为:
4CO2 +
2X + 6H2O, 则X的化学式为:
A.SO3
B.SO
29.为解决日益加剧的温室效应等问题,科学家正在研究建立如下图所示的二氧化碳新循环体系:
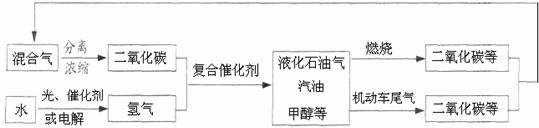
上述关系图能反映的化学观点或化学思想有:
①化学变化中元素种类是守恒的;②燃烧时化学能可以转化为热能和光能;
③化学能可以转化为机械能; ④光能或电能可以转化为化学能;
⑤无机物和有机物可以相互转化;⑥二氧化碳也是一种重要的资源。
A.①②③ B.①②③④⑤ C.①④⑤⑥ D.①②③④⑤⑥
30.对甲、乙、丙三种金属活动性的实验研究过程如下:(1)取大小相等的三种金属片,分别放入CuSO4溶液中,一段时间后,甲、丙表面出现红色物质,乙没有现象。(2)取大小相等的甲、丙两种金属片,分别放入相同的稀盐酸中,甲、丙表面都产生气泡,但甲产生气泡的速度明显比丙的快。则甲、乙、丙三种金属的活动性顺序是
A.甲>丙>乙 B.丙>乙>甲 C. 甲>乙>丙 D . 丙>甲>乙
第Ⅱ卷(非选择题 共116分)
一、理解与应用(本大题4小题,共18分)
1.(4分)去年我国“世界环境日”的主题为“绿色奥运与环境友好型社会”。
⑴ 北京奥运会采取的下列措施中,与“绿色奥运”理念无关的是: 。(填序号)
①招募志愿者为奥运会提供服务;
②在奥运场地使用新型清洁燃料汽车;
③奥运工程建设中,应用太阳能、地热等能源。
⑵ “祥云”火炬的燃料是丙烷(C3H8),丙烷在空气中点燃生成二氧化碳和水,符合“绿色奥运”的要求,其化学方程式为 。
⑶ 汽车尾气中含有CO和NO,消除这两种物质对大气污染的方法是在汽车的排气管上装一个“催化转化器”,使它们发生反应生成两种参与大气循环的气体。这两种气体是:
和 。
2.(4分)联合钢铁工业的基本生产流程示意图如下:

请回答下列问题:
(1)写出以赤铁矿为原料在高温下与一氧化碳反应制取铁的化学方程式:
;
(2)应用化学原理分析,工业炼钢时用纯氧而不用空气的原因是:
;
(3)铁粉与生石灰都是常用的干燥剂,现欲用化学方法检验某食品袋中的干燥剂究竟是其中的哪一种?请你简述方法和现象:
。
3.(7分)“水是生命之源”,这句话不仅说明水是一种重要的营养素,还告诉我们水可以溶解许多物质,供给生命需要。但水中溶解不同的物质会对生命活动产生不同的影响。
(1)鱼类可在水中呼吸,是因为水中溶解有__________(填粒子符号,下同)。含硫酸的工业废水排放到江河中会增加大量的______________,使水显酸性,造成鱼类死亡。
(2)酸性溶液不利于鱼类生存,但在工业生产中却有重要的用途,如旧电器中的铜锌合金可利用硫酸进行分离,发生反应的化学方程式为_____________________________。锌在硫酸中溶解而铜不溶,这说明锌比铜的金属活动性___________。
(3)常用洗洁精洗涤油污,因为洗洁精与油、水混合会产生 作用;冬天常在汽车的水箱中加入少量乙二醇之类的化合物可以防止水箱中的水结冰,因为乙二醇溶于水后使溶液的凝固点 。(填“升高”或“降低”)
4.(3分) 图A是元素周期表的一部分

ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
第二
周期
3 Li
锂
7
4 Be
铍
9
5 B
硼
11
①
7 N
氮
14
8 O
氧
16
氟
19
10 Ne
氖
20
第三
周期
11 Na
钠
23
②
13 Al
铝
27
14 Si
硅
28
③
16 S
硫
32
17 Cl
氯
35.5
18 Ar
氩
40
图B  图C
图C
(1)原子序数为14的元素名称为 ;
(2)图B是某元素的原子结构示意图,该元素在图A中的位置是(填①或②或③) ;
(3)图C是氯元素的原子结构示意图,图A中与氯元素在同一纵行的氟元素,其原子结构与氯原子相似。由此推测氟原子在化学反应中易(填“得”或“失”) 电子。
二、实验与探究(本大题2小题,共13分)
5.(6分)实验室常用下列装置来制取氧气:
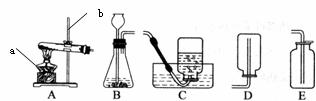
(1)用双氧水和二氧化锰来制取氧气时,可选用的发生装置是 (填序号),其中二氧化锰起 作用。
(2)用E装置收集氧气的依据是 。
(3)实验室常用氯化铵固体与碱石灰固体共热来制取氨气。常温下NH3是一种无色、有刺激性气味的气体,密度比空气小。NH3极易溶于水,其水溶液呈碱性。
①制取氨气反应的方程式:2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑+ 2X。则X的化学式为: 。
CaCl2 + 2NH3↑+ 2X。则X的化学式为: 。
②制取并收集NH3,应该从上图中选择的装置是 _____。
③NH3是一种碱性气体,干燥时不能选用下列干燥剂中的 (填序号)。
A.固体氢氧化钠 B.浓硫酸 C.生石灰
6.(7分)在学习了质量守恒定律后,小明和小华来到实验室,他们用下图所示的实验装置,验证了氢氧化钠溶液和硫酸铜溶液反应是符合质量守恒定律的。
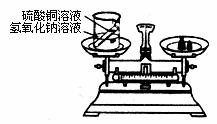
(1) 请写出该反应的化学方程式 ;
(2) 实验结束后,在整理仪器时小明发现,原来氢氧化钠溶液是放在敞口容器中。于是他们对刚刚完成的实验产生了疑问:
[提出问题]①氢氧化钠是否变质;②如果氢氧化钠溶液已经变质,“变质”的氢氧化钠溶液与硫酸铜溶液反应为什么仍然符合质量守恒定律。
[查找资料]部分铜盐的溶解性表(
阴离子
阳离子
SO42-
NO3-
PO43-
Cl-
CO32-
Cu2+
溶
溶
不
溶
不
(3)请你帮助他们完成下面的探究:
[设计实验]怎样确定氢氧化钠是否变质?
实验过程
实验现象
结 论
[解释与分析]①假如氢氧化钠已变质,请写出氢氧化钠变质的化学方程式 ;
②“变质”的氢氧化钠溶液与硫酸铜溶液反应,为什么仍然符合质量守恒定律:
。
三、分析与计算(本大题1小题,共5分)
7.(5分)用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠。为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品
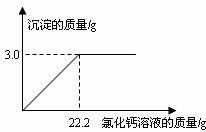
求:(1)该纯碱样品中碳酸钠的质量分数。(精确到0.1%)
(2)所加入氯化钙溶液的溶质质量分数。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com