
气 体 Cl2 HCl H2S CO2 1体积水约能吸收气体体积数 2 500
试题详情
试题详情
试题详情
16.下列溶液中有关物质的量浓度关系正确的是 A.pH=2的HA溶液与pH=12的MOH溶液任意比混合: c(H+) + c(M+) == c(OH-) + c(A-) B. pH相等的CH3COONa、NaOH和Na2CO3三种溶液: c(NaOH)<c(CH3COONa)<c(Na2CO3) C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合: c(CH3COO-) +2c(OH-)
== 2c(H+) + c(CH3COOH) 试题详情
D.0.1mol?L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) 试题详情
 17.右图中,两电极上发生的电极反应为: a极:Cu2++2e一=Cu b极:Fe-2e一=Fe2+,下列说法中不正确的是( ) 17.右图中,两电极上发生的电极反应为: a极:Cu2++2e一=Cu b极:Fe-2e一=Fe2+,下列说法中不正确的是( )
A.该装置可能是电解池 B.a极上发生的是氧化反应
C.a、b可能是同种电极材料 D.该装置在工作时,溶液中的阳离子可能向b极移动 试题详情
18.在一密闭容器中有如下反应:aX(g)+bY(g) 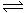 nW(g);ΔH=Q。某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图: nW(g);ΔH=Q。某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图: 试题详情
其中,ω(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是 A.图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b<n B.图Ⅲ可能是不同温度对反应的影响,且T1>T2,ΔH<0 C.图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b D.图Ⅱ可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好 第Ⅱ卷(共87分) 试题详情
三、(本题包括3小题,共34分) 19.(10分)已探明我国锰矿储量占世界第三位,但富矿仅占6.4%,每年尚需进口大量锰矿石。有人设计了把我国的贫菱锰矿(MnCO3含量较低)转化为高品位“菱锰矿砂”(MnCO3含量高)的绿色工艺。该工艺流程如下图所示: 试题详情

已知焙烧反应①的化学方程式:(NH4)2SO4+MnCO3MnSO4+2NH3↑+CO2↑+H2O。 (1)写出反应②的离子方程式_______________________________________。 (2)上述工艺流程中,可以循环利用的物质有(NH4)2SO4、____________、__________。从物料平衡角度看,理论上生产过程中_________(填“需要”或者“不需要”)添加(NH4)2SO4。 试题详情
(3)向物质的量浓度均为0.01mol?L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的是________(填离子符号);当两种沉淀共存时,溶液中 =________。 =________。 试题详情
[Ksp(BaCO3)=8.1×10-9,Ksp(MnCO3)=1.8×10-11] 试题详情
20.(12分)某溶液中可能含有SO32―、SO42―、 HCO3―
三种离子中的两种或三种。为探究其组成,小明取出两份相同的样品溶液于试管中,向一份中加入过量的盐酸,产生无色气泡;向另一份中滴加过量的氯化钡溶液,产生白色沉淀。请设计合理实验,做进一步的探究,对小明的实验给出结论。 仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、集气瓶、铁架台、漏斗、滤纸、酒精灯、带单孔胶塞的导管;lmol/L硫酸;2mol/L盐酸;2mol/L硝酸、;lmol/L氯化钡、澄清石灰水、品红溶液、蒸馏水。 完成下列探究过程: (1)提出假设: 假设 l :溶液中存在SO32―、SO42― 假设 2 : 假设 3 :
假设 4 :溶液中存在SO32―、SO42―、 HCO3― (2) 基于假设4 , 设计出实验方案,将实验操作、预期的实验现象和结论填在下表中。 [提示]I、在答题卡上按照下表的方式作答,注意前后内容的对应。 Ⅱ、注意文字简洁,超出答题卡空间视为无效。 III 、可不填满,也可增加步骤。 步骤编号 实验操作 预期现象和结论 ① ② ③ ④ …… …… …… 试题详情
21.(12分)近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。 ⑴有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。 ① 写出步骤(I)反应的化学方程式: ② 写出步骤(III)反应的离子方程式: ⑵还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。 试题详情

① 该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填序号) 。 试题详情
 A.碘的淀粉溶液 B.酸性高锰酸钾溶液 C.氢氧化钠溶液 D.氯化钡溶液 ② 若上述实验是在标准状况下进行的,X是已知体积和物质的量浓度的溶液,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是 (3) 新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合物中通入适量的氨气得到一种产品。该技术的优点是 。 试题详情
(4) 为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+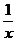 Sx 、 Sx 、 试题详情
CO+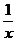 Sx=COS、2COS+SO2=2CO2+ Sx=COS、2COS+SO2=2CO2+ Sx 。其中COS中“C”化合价为 。 Sx 。其中COS中“C”化合价为 。 (5)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇,NO3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式 。 试题详情
四、(本题包括3小题,共34分) 22.(10分)广东沿海地区有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。合理利用资源和保护环境是我省可持续发展的重要保证。 ⑴海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式 。 ⑵某化工厂生产过程中会产生含有Cu2+和Pb2+的污水。排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入 (选填“Na2S”或“NaOH”)效果更好。 难溶电解质 Cu(OH)2 CuS Pb(OH)2 PbS Ksp 试题详情
试题详情
试题详情
试题详情
1.0×10-28 ⑶火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示: 试题详情
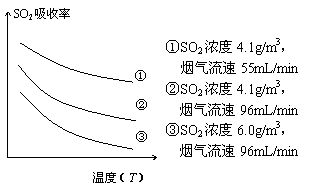
①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因 (任写一个)。 ②某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如右图所示。 请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议:
。 ③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,使用氧气将其氧化的化学原理是 (任写一个化学方程式或离子方程式)。氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是 试题详情
23.(12分) 黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究。 [实验一]为测定硫元素的含量 试题详情
Ⅰ.将m1 g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2 2Fe2O3+8SO2 试题详情

Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理: 试题详情

问题讨论: ⑴.Ⅰ中,甲瓶内所盛试剂是________溶液。乙瓶内发生反应的离子方程式有_________________、_________________。 ⑵.Ⅱ中,所加H2O2溶液(氧化剂)需足量的理由是_____________。 ⑶.该黄铁矿中硫元素的质量分数为______________。 [实验二]设计以下实验方案测定铁元素的含量 试题详情

问题讨论: ⑷.③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有__________。 ⑸.②中,若选用铁粉作还原剂,你认为合理吗?理由是:____________。 试题详情
 24.(12分)将2 mol SO2和1 mol O2混合置于体积可变的密闭容器中,在T1温度下发生如下反应: 24.(12分)将2 mol SO2和1 mol O2混合置于体积可变的密闭容器中,在T1温度下发生如下反应:
试题详情
2SO2(g)+O2(g) 2SO3(g) △H<0 2SO3(g) △H<0 试题详情
当反应进行到时间t0点时达到平衡状态,测得混合气体的总物质的量为2.1 mol。试回答: (1)该反应的平衡常数表达式为 。 (2)反应进行到t0时SO2的体积分数为 。 (3)保持温度不变,若使用催化剂,在图中作出从 反应开始到t0点这段时间SO2物质的量变化曲线。 (4)当反应进行到t1时间时(t1>t0),给上述反应容 器加热到温度T2 (T2>T1),反应在t2 时间时(t2>t1) 重新达到平衡状 态,这时K值 (填“增大” “减小”或“不变”),新平衡混合物中气体的总物质 试题详情
的量 ______2.1 mol(填“<”、“>”或“=”)。 五、(本题包括1小题,9分) 试题详情
试题详情
咖啡酸苯乙酯 是一种天然抗癌药物,在一定条件下能发生如下转化: 是一种天然抗癌药物,在一定条件下能发生如下转化: 试题详情

请填写下列空白。 ⑴.D分子中的官能团是________。 ⑵.高分子M的结构简式是______________。 ⑶.写出A→B反应的化学方程式:___________________。 ⑷.B→C发生的反应类型有______________。 ⑸.A的同分异构体很多种,其中,同时符合下列条件的同分异构体有____种。 ①苯环上只有两个取代基; ②能发生银镜反应; ③能与碳酸氢钠溶液反应; ④能与氯化铁溶液发生显色反应。 六、选择题(本题包括2小题,考生只能选做一题。26小题为“有机化学基础”内容的试题,27小题为“物质结构与性质”内容的试题) 试题详情
26. (10分)某有机物X(C11H9O6Br)分子中有多种官能团,其结构简式为: 试题详情

(其中Ⅰ、Ⅱ为未知部分的结构),为推测X的分子结构,进行如下转化 试题详情

已知向D的水溶液中滴入FeCl3溶液发生显色反应,滴入NaHCO3溶液有无色无味 气体产生,且D苯环上的一氯代物有两种。 (1)D中的官能团名称:
;X的结构简式:
(2)写出E→F的化学方程式:
(3)D可能发生的反应有:
A.加成反应 B.消去反应 C.取代反应 D.氧化反应 E.加聚反应 (4)D有多种同分异构体,遇FeCl3溶液发生显色反应,又能发生银镜反应,其中能水解的同分异构体的结构简式为:
,不能水解的同分异构体的结构简式为:
(各写出一种) 试题详情
27.(10分)目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。 ⑴配合物Ni(CO)4常温为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于
晶体;基态Ni原子的电子排布式为
。 试题详情
⑵配合物 分子内的作用力有
(填编号)。 分子内的作用力有
(填编号)。 A.氢键 B.离子键 C.共价键 D.配位键 试题详情
 ⑶很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH≡CH、③ ⑶很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH≡CH、③ 、④HCHO等,其中碳原子采取sp2杂化的分子有
(填物质序号),预测HCHO分子的立体结构为
形。 、④HCHO等,其中碳原子采取sp2杂化的分子有
(填物质序号),预测HCHO分子的立体结构为
形。
⑷氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如右图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点。该晶体的化学式
。 2009年珠海市高三第二次调研化学试卷答案 试题详情
第一部分 选择题 (共63分) 1 2 3 4 5 6 7 8 9 B C D D C B A A C 10 11 12 13 14 15 16 17 18 C AD B C B C AC BD AD 第二部分 非选择题 (共87分) 19.(10分)(1)Mn2++2NH3+CO2+H2O=2NH4++MnCO3↓(2分) (2)NH3、CO2 (2分)
不需要(2分) (3)Mn2+(2分) 450(2分) 20.(12分) (l)假设2 :溶液中存在SO32―和HCO3―( 1分) 假设3、溶液中存在HCO3―和SO42―(2和3顺序不限。)(1分) (2)(10分) 步骤编号 实验操作 预期现象和结论 ① 用胶头滴管取少量溶液加入试管A中,再用滴管取过量的lmol/L氯化钡溶液并滴入其中,充分反应后,静置,然后过滤,将沉淀和滤液分别装入另外的两个试管B,C中(3分) 产生白色沉淀,说明原溶液中含有SO42―或SO32―或两者都有(1分) ② 往装有沉淀的试管B中加入过量的2mol/L盐酸, 将产生的气体通入品红溶液(2分) 沉淀部分溶解, 并产生气体. 品红褪色,说明原溶液中一定含有SO42―和SO32―(1分) ③ 往装有滤液的试管C中加入2mol/L盐酸; 或加入澄清石灰水(2分) 出现无色气泡, 澄清溶液变浑浊,说明原溶液中含有HCO3―(1分) ④ 其它方案合理给分 21(12分)(1)SO2+NaOH=NaHSO3 (1分) HSO3-+H+==SO2+H2O (1分) (2) AB (2分) 实验时间和加入盐酸酸化的氯化钡溶液后生成沉淀的质量 (2分)
(3)变废为肥,充分利用资源,降低污染 (2分) (4)+4 (2分) (5)5CH3OH+6NO3--+6H+ ==5CO2+3N2+13H2O (2分) 22.(10分)⑴MgCl2(熔融)  Mg+Cl2↑
(2分) ⑵Na2S (1分) Mg+Cl2↑
(2分) ⑵Na2S (1分) ⑶①CO32-+H2O HCO3-+OH-(或2H2SO4)或 HCO3-+H2O HCO3-+OH-(或2H2SO4)或 HCO3-+H2O H2CO3 +OH- (2分) H2CO3 +OH- (2分) ②降低含硫烟气的温度(或减小含硫烟气的流速)(2分) ③2H2SO3+O2=4H++2SO42-或2HSO3-+O2=2H++2SO42- (2分) 中和、稀释经氧气氧化后海水中生成的酸(H+),减少污染。(1分) 23.(12分) ⑴.氢氧化钠(或氢氧化钾) (1分) SO2+2OH?=SO32-+H2O (2分) 2SO32-+O2=2SO42? (2分) ⑵.使SO32-完全氧化为SO42? (2分) ⑶. (或其它合理答案) (2分) (或其它合理答案) (2分) ⑷.250 mL容量瓶 (1分) ⑸.不合理,会使所测得的铁元素的质量分数偏大(或其它合理答案)(2分) 24.(12分)(1)错误!不能通过编辑域代码创建对象。 (2分)
 (2)9.52 %
(2分) (2)9.52 %
(2分)
(3)如图所示[注:只要起点在横坐标轴(0,2), 平衡点在横坐标0点后t0前、纵坐标0.2处的示意 图均给分)(4分) (4)减小 (2分)>(2分)  25(9分) 25(9分)

26.(1)羟基 羧基
(2分) 错误!不能通过编辑域代码创建对象。 (2分) (2) 错误!不能通过编辑域代码创建对象。(2分) (3)A C D (2分) (4) 错误!不能通过编辑域代码创建对象。 错误!不能通过编辑域代码创建对象。 (2分) 27.⑴分子 (1分) 1s2s22p63s23p63d84s2或[Ar]3d84s2 (2分) ⑵ACD (2分) ⑶①、③、④ (2分)平面三角 (1分) ⑷LaNi5或Ni5La (2分)
| 
 Fe原子,有关
Fe原子,有关 Fe的说法正确的是
Fe的说法正确的是 Fe 与
Fe 与 Fe互为同位素
Fe互为同位素 Fe原子核外有19个电子 D这种铁原子发生衰变放出两个质子后变成
Fe原子核外有19个电子 D这种铁原子发生衰变放出两个质子后变成 Fe.
Fe. (“→”表示一步完成)关系相互转化的是:
(“→”表示一步完成)关系相互转化的是:  a.CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g)
a.CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g) 
 O2(g)→3H2(g)+2CO(g)
O2(g)→3H2(g)+2CO(g) 


 ,b与c形成化合物的电子式为下列比较中正确的是
,b与c形成化合物的电子式为下列比较中正确的是 H2CO3 +2OH-
H2CO3 +2OH- CaSO3+2HClO
CaSO3+2HClO