
题目列表(包括答案和解析)
某碳、氢化合物1.5g,在纯氧气中完全燃烧后生成二氧化碳4.4g,此化合物中含氢元素的质量分数是 %
某制碱厂以海水为主要原料生产纯碱(碳酸钠)和其他副产品。
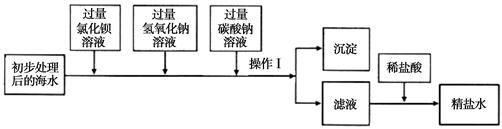
(一)将海水进行处理后获得精盐水。海水中,除氯化钠外,还含有氯化镁、氯化钙、硫酸钠
等杂质。其处理的主要流程如下:

(1)加入氢氧化钠溶液的目的是 。
(2)操作Ⅰ所得的沉淀是混合物,其成分有(至少写两种): 。
(3)向滤液中滴加稀盐酸目的是 。
(二)将精盐水制成饱和溶液,先向其中通入足量的氨气,再向其中通入足量的二氧化碳至有大量晶体(碳酸氢钠,NaHCO3)析出;将晶体转移出来后,加热至不再有气体产生,所得固体即为纯碱。
(4)制碱过程中获得的副产品可做化肥,其化学式为 。
组成确定
(5)①称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;② 另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。由上述实验可确定纯碱样品含有杂质 (写化学式)。
含量测定
(6)称取纯碱样品21.5g,加入到盛有足量稀盐酸的烧杯中,并不断用玻璃棒搅拌。反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如图所示。
请通过计算并结合右表判断此纯碱样品等级为 ![]() 品。
品。
计算过程:
总结反思
(7)某同学认为,在上述纯碱含量测定过程中,用玻璃棒不断搅拌,能使测定误差会减小,
其理由是 。
 |
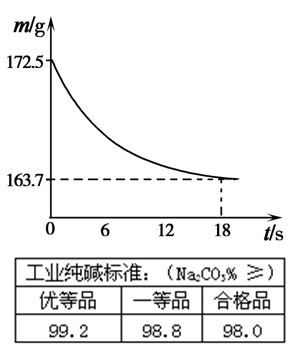

| 工业纯碱标准:(Na2CO3%》) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
(9分)某制碱厂以海水为主要原料生产纯碱(碳酸钠)和其他副产品。
(一)将海水进行处理后获得精盐水。海水中,除氯化钠外,还含有氯化镁、氯化钙、硫酸钠等杂质。其处理的主要流程如下:
(1)加入氢氧化钠溶液的目的是 。
(2)操作Ⅰ所得的沉淀是混合物,其成分有(至少写两种): 。
(3)向滤液中滴加稀盐酸目的是 。
(二)将精盐水制成饱和溶液,先向其中通入足量的氨气,再向其中通入足量的二氧化碳至有大量晶体(碳酸氢钠,NaHCO3)析出;将晶体转移出来后,加热至不再有气体产生,所得固体即为纯碱。
(4)制碱过程中获得的副产品可做化肥,其化学式为 。
组成确定
(5)①称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;② 另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。由上述实验可确定纯碱样品含有杂质 (写化学式)。
含量测定
(6)称取纯碱样品21.5g,加入到盛有足量稀盐酸的烧杯中,并不断用玻璃棒搅拌。反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如图所示。请通过计算并结合右表判断此纯碱样品等级为 品。
计算过程: 
总结反思
(7)某同学认为,在上述纯碱含量测定过程中,用玻璃棒不断搅拌,能使测定误差会减小,其理由是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com