
题目列表(包括答案和解析)
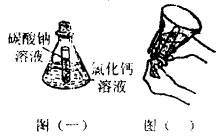
A.混合后会产生沉淀
B.混合后会产生气泡
C.混合后溶液变为红色
D.混合后总质量大于混合前
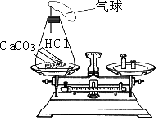
为了验证质量守恒定律,小亮同学做了如图所示的实验,反应前天平平衡,取下锥形瓶装置,(装置气密性良好)将其倾斜,使稀盐酸与大理石接触,待充分反应后,气球膨胀,再将锥形瓶装置放回天平左盘,小亮同学却发现天平的指针向右偏转.请你分析这一现象是否遵守质量守恒定律?________.为什么?________________.
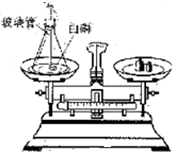 如图是探究质量守恒的实验装置,雅思、敏洁两位同学在底部铺有细沙的锥形瓶中,放入一粒火柴头大的白磷,在锥形瓶口的橡皮塞上安装一根玻璃管,在其上端系牢一个小气球,并使玻璃管下端能与白磷接触.将锥形瓶和玻璃管放在托盘天平上用砝码平衡.然后取下锥形瓶,雅思同学将橡皮塞上的玻璃管放在酒精灯火焰上灼 烧至红热后,迅速用橡皮塞将锥形瓶塞紧,并将白磷引燃.冷却后,称量.观察天平是否平衡.
如图是探究质量守恒的实验装置,雅思、敏洁两位同学在底部铺有细沙的锥形瓶中,放入一粒火柴头大的白磷,在锥形瓶口的橡皮塞上安装一根玻璃管,在其上端系牢一个小气球,并使玻璃管下端能与白磷接触.将锥形瓶和玻璃管放在托盘天平上用砝码平衡.然后取下锥形瓶,雅思同学将橡皮塞上的玻璃管放在酒精灯火焰上灼 烧至红热后,迅速用橡皮塞将锥形瓶塞紧,并将白磷引燃.冷却后,称量.观察天平是否平衡.
| ||
| ||
| 操作步骤及实验现象 | 简答 |
| ①在底部铺有细沙的锥形瓶中,放入一小块金属钠,塞紧橡皮塞,称量,用砝码使天平平衡. | 称量前需要 检查天平是否平衡 检查天平是否平衡 |
| ②取下锥形瓶,放在垫有石棉网的三脚架上微热,观察到金属钠着火燃烧,冷却后,再称量. | 称量时观察到 天平保持平衡 天平保持平衡 |
| ③将锥形瓶塞取出一会儿后,盖上瓶塞,再称量. | 称量时观察到 天平指针向左偏转 天平指针向左偏转 |
| 操作步骤及实验现象 | 简答 |
| ①在底部铺有细沙的锥形瓶中,放入一小块金属钠,塞紧橡皮塞,称量,用砝码使天平平衡. | 称量前需要______ |
| ②取下锥形瓶,放在垫有石棉网的三脚架上微热,观察到金属钠着火燃烧,冷却后,再称量. | 称量时观察到______ |
| ③将锥形瓶塞取出一会儿后,盖上瓶塞,再称量. | 称量时观察到______ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com