
题目列表(包括答案和解析)
(1)丙 (3分)
(2)解:设生成2.9克Mg(OH)2消耗MgCl2的质量为x,生成NaCl的质量为y,则
MgCl2 +2NaOH==Mg(OH)2↓+ 2NaCI (1分)
95 58 117
x 2.9 g y
95:58 =x:2.9 g x=4.75g (1分)
117:58 =y:2.9 g y=5.85g (1分)
混合物中MgCl2 的质量分数为: ![]() ×100%=95.0% (2分)
×100%=95.0% (2分)
(3)乙同学实验后溶液中NaCl的质量:5.0 g-4.75 g +5.85 g =6.1 g (1分)
乙同学实验后溶液的质量:25.0 g +40.0 g-2.9 g =62.1 g (1分)
乙同学实验后所得溶液中氯化钠的质量分数:![]() ×100%=9.8% (2分)
×100%=9.8% (2分)
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶解度/g | 氯化钠 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| 硫酸钠 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 | |
| 氯化钙 | 59.5 | 65.0 | 74.5 | 100 | 116 | |
| 氯化镁 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 |

某盐水主要是含氯化钠,此外还含有较多硫酸钠,以及少量的氯化钙和氯化镁。
上述几种物质在不同温度时的溶解度数据如下表:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶解度/g | 氯化钠 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| 硫酸钠 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 | |
| 氯化钙 | 59.5 | 65.0 | 74.5 | 100 | 116 | |
| 氯化镁 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 | |
(1)在同温下,溶解度最大的物质是_______。
(2)根据所提供的溶解度数据,画出氯化镁的溶解度曲线;
 |
(3)从溶液中获得硫酸钠晶体适宜采用_________________的方法。
(4)30℃时,100g氯化钙饱和溶液中,氯化钙的质量为_____g。
| 物质 | M | N | Q | P |
| 反应前质量(g) | 34 | 0 | 2 | 0 |
| 反应后质量(g) | X | 18 | 2 | 16 |
某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品。
(一)有关资料
原料岩盐水主要是含NaCl,此外还含有较多Na2SO4,以及少量CaCl2和MgCl2。
上述几种物质在不同温度时的溶解度数据如下表:
|
温度/℃ |
0 |
10 |
20 |
30 |
40 |
|
|
溶 解 度 /g |
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
|
Na2SO4 |
4.5 |
9.6 |
20.2 |
40.8 |
48.4 |
|
|
CaCl2 |
59.5 |
65.0 |
74.5 |
100 |
116 |
|
|
MgCl2 |
52.9 |
53.8 |
54.8 |
56.0 |
58.0 |
(1)10℃时,饱和Na2SO4溶液中溶质的质量分数是 (精确到0.1 %)。
(二)生产工艺
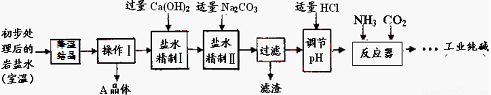
经上述处理后得到主产品:工业纯碱,副产品:A晶体。
(2)“降温”的目的是析出副产品“A晶体”,A的化学式是 ;
(3)反应器中的反应为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。再将NaHCO3晶体转移出来后,加热所得固体即为工业纯碱。在整个生产工艺中没有涉及到的基本反应类型是 ,可重复利用的是 (水除外,只需一种);
(4)在反应器中总是先通氨气,后通二氧化碳,原因是 。
(三)工业纯碱中杂质的判断:
(5)已知:NH4Cl NH3↑+HCl↑
实验步骤:①取一定质量的纯碱样品,经多次充分加热后再称重,发现质量无变化;
②另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。
由上述实验可确定纯碱样品含有杂质 (写化学式)。
(四)含量测定
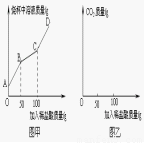
(6)称取纯碱样品21.3g于烧杯中,加入适量水将其溶解, 然后逐滴加入溶质质量分数为14.6%的稀盐酸并不断用玻璃棒搅拌。先发生反应:Na2CO3+HCl=NaHCO3+ NaCl;后发生反应:NaHCO3+HCl= NaCl+H2O+CO2↑。在上述过程中烧杯中溶液质量与加入稀盐酸质量的关系如图甲所示(不考虑CO2的溶解),请你根据图甲提供的信息计算检测过程中产生CO2的质量 。
(7)请通过计算并结合左表判断此纯碱样品等级为 品。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com