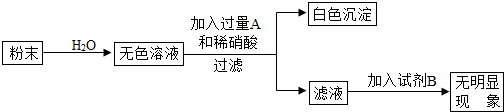
有一包粉末,可能由NaCl、Na
2SO
4、Na
2CO
3、FeCl
3、MgCl
2中的一种或几种物质组成.现做如下实验:①:少量粉末,加水溶解得到无色透明溶液;②:取①所得溶液少许,加入NaOH溶液,看不到明显现象;③:另取少量粉末滴加稀盐酸,也看不到明显现象.试回答:
(1)由实验①可知,原粉末中一定没有
FeCl3
FeCl3
;实验②可说明粉末中没有
MgCl2
MgCl2
;实验③证明原粉末中一定没有
Na2CO3
Na2CO3
.
(2)根据上述实验,可得出原粉末中可能有的物质是
NaCl、Na2SO4
NaCl、Na2SO4
.如果需要进一步确定原粉末是纯净物还是混合物,你准备继续进行的实验是
④
另取少量粉末,加水溶解,加入过量的Ba(NO3)2溶液,若有白色沉淀产生,证明有硫酸钠;反之,没有硫酸钠
另取少量粉末,加水溶解,加入过量的Ba(NO3)2溶液,若有白色沉淀产生,证明有硫酸钠;反之,没有硫酸钠
;
⑤
继续滴加AgNO3溶液,若有白色沉淀产生,证明有氯化钠,反之,没有氯化钠
继续滴加AgNO3溶液,若有白色沉淀产生,证明有氯化钠,反之,没有氯化钠
.