
题目列表(包括答案和解析)
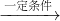 X+H2O,其中X的化学式为______.
X+H2O,其中X的化学式为______. “
“ ”和“
”和“ ”分别表示不同元素的原子:
”分别表示不同元素的原子: ”聚集成的物质______(填“可能”或“不可能”)是氧化物,参加反应的两种反应物分子“
”聚集成的物质______(填“可能”或“不可能”)是氧化物,参加反应的两种反应物分子“ ”与“
”与“ ”的个数比为______.
”的个数比为______.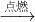 CO2(氧气充足),2C+O2
CO2(氧气充足),2C+O2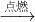 2CO(氧气不足);已知1mol碳充分燃烧放出393.5千焦的热量,不充分燃烧(生成CO)放出110.5千焦的热量.由上可知,煤燃烧不充分引发的弊端有______.
2CO(氧气不足);已知1mol碳充分燃烧放出393.5千焦的热量,不充分燃烧(生成CO)放出110.5千焦的热量.由上可知,煤燃烧不充分引发的弊端有______. ,其中X的化学式为_____________。
,其中X的化学式为_____________。 ”和“
”和“ ”分别表示不同元素的原子: 由“
”分别表示不同元素的原子: 由“ ”聚集成的物质__________(填“可能”或“不可能”)是氧化物,参加反应的两种反应物分子“
”聚集成的物质__________(填“可能”或“不可能”)是氧化物,参加反应的两种反应物分子“  ”与“
”与“ ”的个数比为____________。
”的个数比为____________。
 CO2(氧气充足), 2C+O2
CO2(氧气充足), 2C+O2 2CO(氧气不足);已知1mol碳充分燃烧放出393.5千焦的热量,不充分燃烧(生成CO)放出110.5千焦的热量。由上可知,煤燃烧不充分引发的弊端有_____________。
2CO(氧气不足);已知1mol碳充分燃烧放出393.5千焦的热量,不充分燃烧(生成CO)放出110.5千焦的热量。由上可知,煤燃烧不充分引发的弊端有_____________。 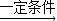 X+H2O,其中X的化学式为 .
X+H2O,其中X的化学式为 . ”和“
”和“ ”分别表示不同元素的原子:
”分别表示不同元素的原子: ”聚集成的物质 (填“可能”或“不可能”)是氧化物,参加反应的两种反应物分子“
”聚集成的物质 (填“可能”或“不可能”)是氧化物,参加反应的两种反应物分子“ ”与“
”与“ ”的个数比为 .
”的个数比为 . CO2(氧气充足),2C+O2
CO2(氧气充足),2C+O2 2CO(氧气不足);已知1mol碳充分燃烧放出393.5千焦的热量,不充分燃烧(生成CO)放出110.5千焦的热量.由上可知,煤燃烧不充分引发的弊端有 .
2CO(氧气不足);已知1mol碳充分燃烧放出393.5千焦的热量,不充分燃烧(生成CO)放出110.5千焦的热量.由上可知,煤燃烧不充分引发的弊端有 .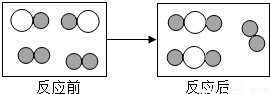
 X+H2O,其中X的化学式为 .
X+H2O,其中X的化学式为 . ”和“
”和“ ”分别表示不同元素的原子:
”分别表示不同元素的原子: ”聚集成的物质 (填“可能”或“不可能”)是氧化物,参加反应的两种反应物分子“
”聚集成的物质 (填“可能”或“不可能”)是氧化物,参加反应的两种反应物分子“ ”与“
”与“ ”的个数比为 .
”的个数比为 . CO2(氧气充足),2C+O2
CO2(氧气充足),2C+O2 2CO(氧气不足);已知1mol碳充分燃烧放出393.5千焦的热量,不充分燃烧(生成CO)放出110.5千焦的热量.由上可知,煤燃烧不充分引发的弊端有 .
2CO(氧气不足);已知1mol碳充分燃烧放出393.5千焦的热量,不充分燃烧(生成CO)放出110.5千焦的热量.由上可知,煤燃烧不充分引发的弊端有 .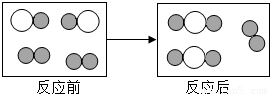
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com