29、(1)化学小组同学用下列仪器和试剂,验证金属与盐酸反应速率的影响因素.
实验仪器:烧杯、石棉网、酒精灯、铁架台(带铁圈)、镊子、量筒、天平等.
实验试剂:锌片、铁片、镁片.溶质质量分数分别为5%、20%的盐酸.
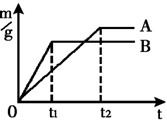
①不同金属与酸反应的快慢不同取质量相等的镁、锌、铁中两种金属,分别放入溶质质量分数相同的足量稀盐酸中,生成氢气的质量(m)与反应时间(t)的关系曲线如图所示.则线B对应的金属为
Zn
,线A对应的金属与稀盐酸反应的化学方程式为
Fe+2HCl═FeCl2+H2↑
.
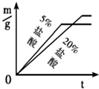
②同种金属与不同溶质质量分数的盐酸反应的快慢不同取两份质量相等的锌片,分别放入5%和20%的足量
稀盐酸中,生成氢气的质量为m,反应时间为t.对比5%和20%的稀盐酸分别与锌片反应情况,下列关系曲线正确的是
C
(填字母序号).
A.
B.

C.
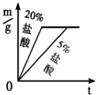
D.
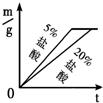
实验表明,盐酸中溶质的质量分数越大,与金属反应的速率越快.
③温度对金属与盐酸反应速率也有影响,且实验表明,温度越高,盐酸与金属反应的速率越快.请用控制变量的方法设计实验,验证以上结论,实验方案为
取两份质量相等的铁片,分别放入盛有5%的足量稀盐酸的烧杯中,将其中一只烧杯里溶液加热,观察两只烧杯中产生气泡的快慢
.
(2)同学们做完实验后,将含有CuCl
2、ZnCl
2、FeCl
2的废液倒在废液缸里,如果将废液直接排放,就会造成水污染.于是几位同学利用课余时间处理废液,回收工业重要原料氯化锌和有关金属.实验过程如下图所示.
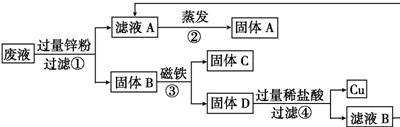
请回答:
①滤液A和滤液B含有的一种相同溶质的化学式是
ZnCl2
;
②写出步骤①反应的化学方程式
Zn+CuCl2═ZnCl2+Cu
;
③检验步骤④中加入的稀盐酸是否过量的方法是
Zn+FeCl2═Fe+ZnCl2
.

 (1)在非金属单质中,活泼性强的非金属可以把活泼性弱的非金属从溶液中置换出来.例如:Cl2+2NaBr=Br2+2NaCl Br2+2NaI=I2+2NaBr I2+Na2S=S↓+2NaI Cl2+2NaI=I2+2NaCl
(1)在非金属单质中,活泼性强的非金属可以把活泼性弱的非金属从溶液中置换出来.例如:Cl2+2NaBr=Br2+2NaCl Br2+2NaI=I2+2NaBr I2+Na2S=S↓+2NaI Cl2+2NaI=I2+2NaCl
 B.
B. C.
C. D.
D.
