
题目列表(包括答案和解析)
| 品名:504双吸剂 成分:铁粉、生石灰等 |
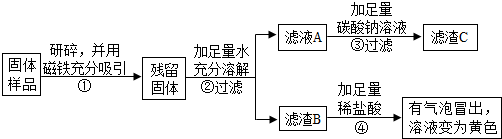
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红. | 固体中一定含有 氧化钙 氧化钙 和氢氧化钙. |
| (2)另取少量固体放于试管中,滴加足量的 稀盐酸 稀盐酸 . |
固体逐渐消失,有大量无色气体产生,得到浅绿色溶液. | 固体中一定含有 铁 铁 ,一定不含Fe2O3 |
| (3)将步骤(2)中产生的气体通入到澄清的石灰水中 | 澄清的石灰水变浑浊 澄清的石灰水变浑浊 |
固体中一定含有CaCO3 |

| ||
| ||
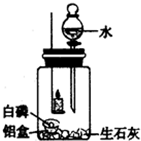 (2007?怀柔区二模)某化学活动小组在探究物质燃烧的条件时,用一个集气瓶罩住燃着的小蜡烛,小蜡烛一会儿就熄灭了.它为什么会熄灭呢?每个人都提出了不同的猜想:
(2007?怀柔区二模)某化学活动小组在探究物质燃烧的条件时,用一个集气瓶罩住燃着的小蜡烛,小蜡烛一会儿就熄灭了.它为什么会熄灭呢?每个人都提出了不同的猜想:| 实验步骤 | 实验现象 | 实验分析 | 实验结论 |
| (1)取一小块白磷(着火点为40℃),放在一铝箔制的小盒内,然后放入装有生石灰的集气瓶内.点燃蜡烛,塞紧胶塞,观察现象. | 燃烧的蜡烛一会儿就熄灭了. |
白磷燃烧需满足的条件: ①温度达到着火点; ② 与氧气接触 与氧气接触 . |
丙的猜想是正确的. |
| (2)待冷却后,打开分液漏斗活塞,向集气瓶中注入少量水,立即关闭活塞,观察现象. | 铝箔中的白磷燃烧,放出热量,同时产生白烟 |
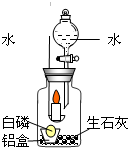 某化学实验小组在探究物质燃烧条件时,用一个集气瓶罩住燃着的小蜡烛,小蜡烛一会儿就熄灭了.它为什么会熄灭呢?每个人都提出了不同的猜想.
某化学实验小组在探究物质燃烧条件时,用一个集气瓶罩住燃着的小蜡烛,小蜡烛一会儿就熄灭了.它为什么会熄灭呢?每个人都提出了不同的猜想.| 实验步骤 | 实验现象 | 实验分析 | 实验结论 |
| 1.取一小块白磷放在一铝箔制的小盒中,然后放入装有生石灰的集气瓶内,点燃蜡烛,塞紧胶塞,观察现象. | 燃烧的蜡烛一会儿就熄灭了. | 蜡烛燃烧需满足的条件: ①温度达到着火点 ② |
丁同学的猜想是正确的 |
| 2.待冷却后,打开分液漏斗活塞,向集气瓶中注入少量的水,立即关闭活塞,观察现象. | 铝盒中的白磷燃烧,放出热量的同时产生了白烟. | 白磷燃烧满足的条件与蜡烛燃烧的条件相同,白磷燃烧的方程式: |
| 实验操作 | 实验现象 | 结论 | |
| 甲 | 取试样加入水中,充分搅拌 | 产生白色浑浊 | 一定含有CaCO3 |
| 乙 | 取试样加入稀盐酸中 | 产生无色气泡 | 一定含有CaCO3 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com