
题目列表(包括答案和解析)
| NaHCO3 | Na2CO3 | |
| 加入稀盐酸 | 现象Ⅰ | 产生气泡 |
| 加入饱和石灰水 | 溶液变浑浊 | 现象Ⅱ |
| 加入CaCl2溶液 | 无明显现象 | 溶液变浑浊 |
| 加热溶液至沸腾,将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 |
| 实验步骤 | 实验现象 | |
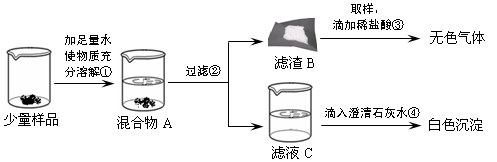
| ①取少量样品溶于水,加入过量的CaCl2溶液. | 有白色沉淀产生 有白色沉淀产生 ; |
该反应的方程式: Na2CO3+CaCl2═CaCO3↓+2NaCl Na2CO3+CaCl2═CaCO3↓+2NaCl . |
| ②将上述反应后的混合液过滤,取滤液 滴加稀盐酸 滴加稀盐酸 . |
有气泡冒出 有气泡冒出 ; |
证明猜想②成立. |
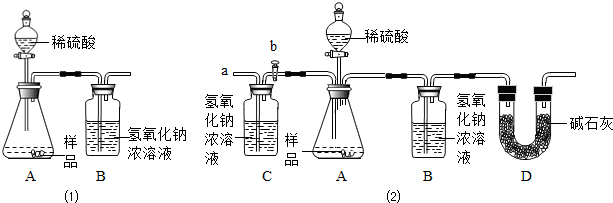

实验室常用的干燥剂“碱石灰”是CaO和NaOH固体的混合物,极易与空气中水蒸气和CO2反应而变质。同学们为确认一瓶久置的“碱石灰”样品的成分,进行如下实验探究。
(1)【猜想】猜想Ⅰ:没有变质,“碱石灰”中只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和 Na2CO3
(2)【实验】如图所示:

|
|
(3)【判断】
a.若Ca(OH)2、CaCO3和Na2CO3溶于水无明显的温度变化,则猜想Ⅱ______________;
(填“成立”或“不成立”)
b.操作③发生反应的化学方程式为______________________________________;
由操作④的现象判断:滤液C中的溶质一定含有_______________(写化学式);
由此判断猜想Ⅰ_________(填“成立”或“不成立”)
c.综合a和b的结论,判断该样品变质情况为____________(填“全部变质”或“部分变质”) 下列对样品成分的分析正确的是______(填序号)。
① 样品中一定含NaOH ② 样品中一定含Na2CO3
③ 样品中含NaOH、CaO中的一种或两种
【拓展】由上述实验说明,实验室中“碱石灰”应_______保存;操作②中玻璃棒的作用是 ___________________。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com