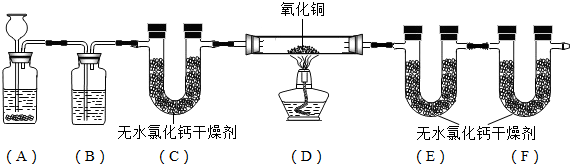
(2012?哈尔滨)电镀是金属防锈的方法之一.某电镀厂有三个分别给金属表面镀锌、镀铜、镀银的车间,每个车间电镀液的溶质中只含有易溶的锌盐、铜盐和银盐中的一种物质.现取三个车间的电镀液于烧杯中,标为1、2、3号,某小组同学通过实验对三种电镀液中溶质成分进行探究.
[提出问题]三种电镀液中溶质的成分是什么?
[探究实验1]
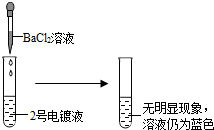
[表达与交流]甲同学认为2号电镀液中的溶质一定不是硫酸铜,你认为他的结论(1)
正确
正确
(填“正确”或“不正确”).
[探究实验2]
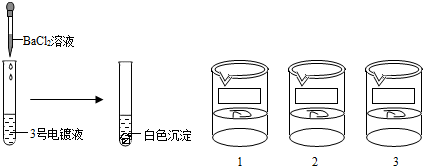
[反思与评价]乙同学认为3号电镀液中的溶质一定是硫酸锌,请你对乙同学的结论给予评价(2)
不正确;3号电镀液中加入氯化钡溶液出现白色沉淀,溶液中可能含有硫酸锌,硫酸锌与氯化钡反应生成硫酸钡是白色沉淀,也可能含硝酸银,硝酸银与氯化钡反应生成氯化银是白色沉淀(或产生白色沉淀只能证明3号溶液中含有硫酸根离子或银离子),因此乙同学认为3号电镀液中的溶质一定是硫酸锌是不正确的
不正确;3号电镀液中加入氯化钡溶液出现白色沉淀,溶液中可能含有硫酸锌,硫酸锌与氯化钡反应生成硫酸钡是白色沉淀,也可能含硝酸银,硝酸银与氯化钡反应生成氯化银是白色沉淀(或产生白色沉淀只能证明3号溶液中含有硫酸根离子或银离子),因此乙同学认为3号电镀液中的溶质一定是硫酸锌是不正确的
.
[探究实验3]根据上述实验,丙同学取少量的1号电镀液与少量的2号电镀液混合,立即出现有(3)
白色沉淀
白色沉淀
生成的明显现象,由此小组同学确定了三种电镀液中分别含有的溶质的成分.
解释与结论:探究实验3中发生反应的化学方程式为(4)
CuCl2+2AgNO3=2AgCl↓+Cu(NO3)2
CuCl2+2AgNO3=2AgCl↓+Cu(NO3)2
,请帮助他们将三种电镀液中溶质成分的化学式填写在烧杯的标签上(5).