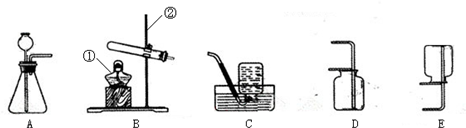
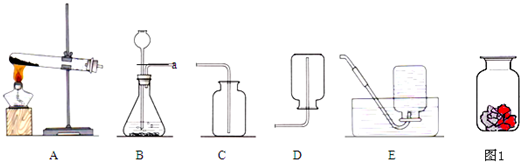
图1是实验室常用的装置,请回答下列问题:
(1)写出仪器①的名称
.收集某气体能采用E装置,由此推测该气体具有的性质是
.
(2)实验室制备并收集氧气的装置组合是
(填装置序号),反应的化学方程式为
;若用F装置收集该气体,则气体应从
端进入(填“a”或“b”);装置A、B都可以用来制取二氧化碳,比较这两个装置,指出A装置的一个突出优点是
.
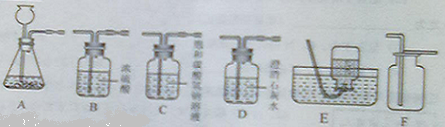
(3)实验室制得的CO
2气体中常含有HCl和水蒸气,为了得到纯净、干燥的CO
2气体,除杂装置的导管气流方向连接顺序是
(填选项字母编号).
A.c→d→e→f B.d→c→e→f C.e→f→c→d D.f→e→d→c
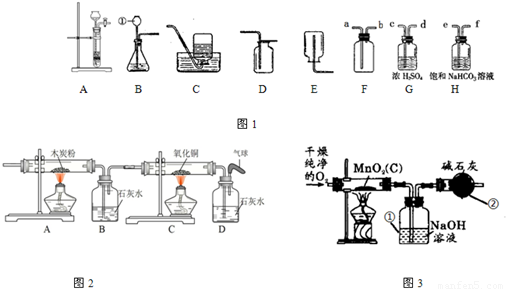
(4)将氧气通入如图2所示的装置,实验中观察到B中澄清石灰水变浑浊,C中黑色固体变为红色,则进入装置B的气体一定含有
,B处发生反应的化学方程式是
.
(5)实验室制取氧气时常用二氧化锰作催化剂.某二氧化锰样品中含有杂质炭,为测定该样品中二氧化锰的质量分数,某兴趣小组设计的实验方案是:在一定量的样品中通入干燥纯净的氧气,使杂质炭在加热条件下反应生成CO
2来进行分析测定.
①如图3所示是用干燥纯净的氧气与样品反应来测定二氧化锰质量分数的装置,仪器②中装有碱石灰(氧化钙和氢氧化钠的混合物),其作用是
.
②为验证装置①已将CO
2吸收完全,可在装置①与②之间加入
装置进行证明.
③现称取5.0g二氧化锰样品进行实验,装置①反应前后的质量差为1.1g,则样品中二氧化锰的质量分数为多少?(写出计算过程)