
题目列表(包括答案和解析)

 CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CH3OH(g)+H2O(g)△H=-49.0kJ/mol
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1molCO2和3molH2 |
 2NH3(g) △H=-93.4kJ/mol
2NH3(g) △H=-93.4kJ/mol


 CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CH3OH(g)+H2O(g)△H=-49.0kJ/mol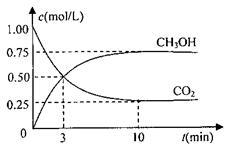
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1molCO2和3molH2 |
 2NH3(g) △H=-93.4kJ/mol
2NH3(g) △H=-93.4kJ/mol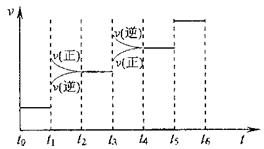

一碳化学是以分子中只含有一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学.CO是从煤的气化或合成气得到的.
(1)煤的气化主要反应有:
①2C+O2=2CO ②C+H2O=CO+H2 ③CO+H2O=CO2+H2
上述反应属于化合反应的是________(填序号),属于氧化反应的是________(填序号).
(2)合成气可通过天然气的重整得到,如CH4+H2O=CO+3H2合成气可制二甲醚,二甲醚被称为21世纪的新型燃料.合成气还可用于冶炼金属,用它冶炼铁的部分生产过程示意如下:

①二甲醚(CH3OCH3)可由合成气(CO和H2)在一定的条件下制的.用合成气制二甲醚时,还产生了一种可参与大气循环的、常温为液态的氧化物,写出该反应的化学方程式:________.
②合成气在冶炼铁的生产过程中所起的作用是________.
(3)化学兴趣小组的同学为了测定某赤铁矿石中氧化铁的质量分数.
Ⅰ.甲同学取一定质量的赤铁矿粉与过量的木炭粉混合后,用下图所示装置以合理的操作步骤测定(假设杂质始终不发生变化).

①实验中持续通入干燥的氮气.加热前缓缓通入一段时间,其作用是________.
②停止加热前是否需要先断开a和b的连接处以防止倒吸?为什么?
________.
③如果氢氧化钠溶液对二氧化碳的吸收是完全的,那么甲同学用氢氧化钠溶液的质最变化测定出氧化铁的质量分数将________(选填“偏大”、“偏小”或“准确”),原因是________.
Ⅱ.乙同学取矿石样品10 g,加入足量稀盐酸,完全反应后,共用去稀盐酸109.5 g过滤得到滤渣2 g(假设杂质既不溶于水也不与酸发生反应).请你和乙同学-起计算赤铁矿石中氧化铁的质量分数和反应后溶液中溶质的质量分数.(请写出计算过程).
碱式碳酸镁密度小,是橡胶制品的优良填料。其组成一般以xMgCO3·yMg(OH)2·zH2O表示。
【探究一】碱式碳酸镁的制备
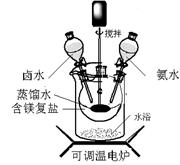
碱式碳酸镁可用复盐MgCO3·(NH4)2CO3·H2O作原料制备。取一定量的该复盐放入三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达 40℃时开始分解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10分钟,一段时间后过滤洗涤,滤出的固体在120 ℃干燥得到碱式碳酸镁产品。
回答下列问题:
(1)①搅拌的目的是 ;②选择水浴加热方式,其优点是 。
(2)所得碱式碳酸镁产品中常检出有少量Cl-,其原因是混有 (填化学式)。
(3)设计实验检验碱式碳酸镁中含有Cl-
|
实验操作 |
实验现象 |
实验结论 |
|
①取样溶解,向样品溶液中滴加过量稀硝酸。 ②再向上述所得溶液加 溶液 |
现象① ; 现象② ; |
含有 Cl- |
【探究二】定量测定碱式碳酸镁的组成
|
已知:碱式碳酸镁分解反应方程式为:xMgCO3·yMg(OH)2·zH2O ="==" (x+y)MgO + xCO2↑+ (y+z) H2O
探究小组利用下图测定xMgCO3·yMg(OH)2·zH2O组成。

实验步骤:
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中。
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4: (请补充该步操作内容)。
步骤5:称量相关装置的质量。
某同学在实验过程中采集了如下数据:
A.反应前玻璃管的质量100.0 g
B.反应后玻璃管与残留固体总质量120.0 g
C.装置C实验后增重9.0 g
D.装置D实验后增重17.6 g
回答下列问题:
(1)检查整套实验装置气密性的方法如下:将装置A的左端、装置E的右端分别接上导管,放入盛有水的烧杯中, ,对装置B用酒精灯微热,观察,若 ,则气密性良好;
(2)如果没有装置A,则测定得到的Z值 (填“偏大”、“偏小”、“无影响”),
装置C中的酸为 (写名称);
(3)根据实验测定的数据,求出碱式碳酸铜(xMgCO3·yMg(OH)2·zH2O)
中x∶y∶z= (要求写出过程,4分)。
【交流反思】
(4)如果不称量装置C实验前后的增重,要根据实验数据,求出x∶y∶z的值,还可测量的实验数据是 。
碱式碳酸镁密度小,是橡胶制品的优良填料。其组成一般以xMgCO3·yMg(OH)2·zH2O表示。
【探究一】碱式碳酸镁的制备
碱式碳酸镁可用复盐MgCO3·(NH4)2CO3·H2O作原料制备。取一定量的该复盐放入三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达 40℃时开始分解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10分钟,一段时间后过滤洗涤,滤出的固体在120 ℃干燥得到碱式碳酸镁产品。
回答下列问题:
(1)①搅拌的目的是 ;②选择水浴加热方式,其优点是 。
(2)所得碱式碳酸镁产品中常检出有少量Cl-,其原因是混有 (填化学式)。
(3)设计实验检验碱式碳酸镁中含有Cl-
| 实验操作 | 实验现象 | 实验结论 |
| ①取样溶解,向样品溶液中滴加过量稀硝酸。 ②再向上述所得溶液加 溶液 | 现象① ; 现象② ; | 含有 Cl- |
|

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com