
题目列表(包括答案和解析)
(1) 2.2g
(2) 解:设纯碱试样中碳酸的质量为x。
Na2CO3+2HCl=2NaCl+H2O+CO2 ↑ (1分)
106 44
x 2.2g (1分)
![]() (1分)
(1分)
x=5.3g (1分)
试样中碳酸钠的质量分数为:
![]() (1分)
(1分)
答:略。
(3)NaCl、HCl
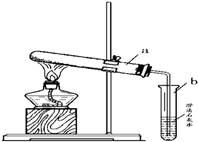 如图所示,取少量碳酸氢铵固体粉末装在试管中,在酒精灯上加热,并将产生的气体通入澄清石灰水中.
如图所示,取少量碳酸氢铵固体粉末装在试管中,在酒精灯上加热,并将产生的气体通入澄清石灰水中.| 加热 |
| 加热 |
| 加入盐酸体积V/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 溶液温度上升(t)/℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |

| 实验方法 | 可能观察到的现象 | 结论 |
| ||
| △ |
| ||
| △ |
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com