
题目列表(包括答案和解析)
| 实验步骤 | 设计目的 |
| 将氢氧化镁加入到热水中搅拌,滴入酚酞试液,并在上方滴一些植物油. | 隔绝空气证明红色消失与氧气和二氧化碳无关 |
| 实验方法 | 可能观察到的现象 | 结论 |
取两只试管,分别加入等质量的的Mg(OH)2和等质量的热水,振荡,各滴入数滴无色酚酞,一只保持温度不变,另一只自然冷却 |
保持温度不变的红色不消失,自然冷却的红色消失. |
红色消失与氢氧化镁的溶解度随温度降低而减小有关 |
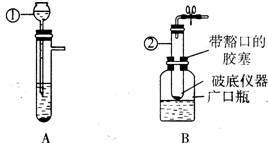 (2006?南平)某校化学兴趣小组的同学设计了以下两种简易装置
(2006?南平)某校化学兴趣小组的同学设计了以下两种简易装置
| 比较项目 | 排水法 | 向上排空气法 |
| 收集方法可行性分析 | CO2气体生成和从水面逸出的速率远大于其溶解和与水反应的速率 | CO2密度比空气大,且 不与空气反应 不与空气反应 |
| 收集过程分析 | 集满现象: 集气瓶内液面下降至瓶口,且气泡从瓶内向外冒出 集气瓶内液面下降至瓶口,且气泡从瓶内向外冒出 |
“验满”分析:因气体无色,故集满与否较难确定.即使用燃着木条移近容器口火焰熄灭,也难以证明空气完全排近 |
| 向收集到CO2的集气瓶内倒入等体积适量澄清石灰水,并振荡 | 先浑浊后变澄清所需时间较短 | 先浑浊后变澄清所需时间较长 |
| 由上述实验可得结论 | (1) 排水法收集二氧化碳比排空气法更纯 排水法收集二氧化碳比排空气法更纯 (2)排水法集满现象明显好操作 排水法集满现象明显好操作 | |
| 编号 | 盐酸 | NaOH溶液 | △t/℃ |
| 1 | 3.65% | 2.00% | 3.5 |
| 2 | 3.65% | 4.00% | x |
| 3 | 7.30% | 8.00% | 14 |
| S02最高浓度限值 | ||
| 一级标准 | 二级标准 | 三级标准 |
| 0.15 | 0.50 | 0.70 |
| 分组 | 第一小组 | 第二小组 |
| 抽气次数 | 120 | 140 |
| 空气中S02的含量 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com