硫酸铜是生产、生活中常见的物质,下面是某学习小组展开的探究实录:
Ⅰ、硫酸铜的制备
(1)某学习小组同学利用铜屑、稀硫酸为原料制备硫酸铜.其原理是在高温条件下将铜粉反复灼烧,使铜充分氧化成氧化铜,再将氧化铜与稀硫酸反应制备硫酸铜,请写出相应的化学方程式
、
CuO+H2SO4=CuSO4+H2O
CuO+H2SO4=CuSO4+H2O
;
(2)通过查阅资料,同学们找到了一种工业制备硫酸铜晶体(CuSO
4?xH
2O)的流程,具体如下:将铜丝放到稀硫酸中,控温在50℃.加入10%的H
2O
2,反应0.5h后,升温到60℃,持续反应1h后,过滤、蒸发、降温结晶等,用少量95%的酒精淋洗后晾干,得CuSO
4?5H
2O.
①写出该工艺流程生成CuSO
4的化学方程式
Cu+H2O2+H2SO4=CuSO4+2H2O
Cu+H2O2+H2SO4=CuSO4+2H2O
;
②在上述生产过程中,控制温度在50℃和60℃加热的原因为
防止H2O2受热分解
防止H2O2受热分解
,
③上述生产流程的优点有
耗能少
耗能少
(写出一种即可);
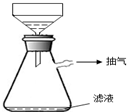
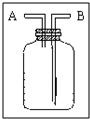
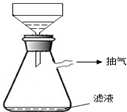
④在过滤时,采用了右图所示的装置,你认为这样做的优点是
加快过滤的速度
加快过滤的速度
;
Ⅱ、硫酸铜的应用及相关实验
(1)波尔多液是用硫酸铜和石灰乳配成的一种天蓝色、粘稠的悬浊液,其有效成分是Cu
4(OH)
6SO
4,其中铜元素的化合价为
+2价
+2价
,该化学式可以写成盐和碱的形式
CuSO4?3Cu(OH)2
CuSO4?3Cu(OH)2
,其杀菌机理可看作是Cu
2+使病原菌失去活性,这说明病原菌的主体是
蛋白质
蛋白质
(填一种有机物名称).
(2)为验证Al的化学性质比铜活泼,小怡做了以下实验,现象如下表:
|
Al片(未打磨) |
Al片(打磨) |
CuSO4溶液
(5%,5mL) |
无变化,数小时后铝片上附有极少气泡,几乎无红色物质 |
极少气泡,附着极少红色物质,持续较长时间 |
CuSO4溶液
(10%,5mL) |
无变化,数小时后铝片附有稍多气泡,仅有极少红色斑点 |
稍多气泡,附着极少(多于5%)红色物质,持续较长时间 |
CuCl2溶液
(5%,5mL) |
多量气泡,迅速出现红色物质,很快溶液变成无色,且温度升高 |
更多量气泡,迅速出现红色物质,很快溶液变成无色,且温度升高 |
认真分析上表,回答下列问题:
①铝和铜盐溶液反应速率与
铝片是否打磨
铝片是否打磨
、
硫酸铜溶液的浓度
硫酸铜溶液的浓度
和
不同的铜盐
不同的铜盐
有关,同时说明铜盐溶液中的Cl
-能
加快
加快
(填“加快”或“抑制”)反应速率,若实验室没有CuCl
2溶液,则可以在CuSO
4溶液中加入少许
盐酸
盐酸
(填物质名称),以使实验现象更为明显;
②该反应过程要
放热
放热
(填“吸热”或“放热”).经检验,产生的气体是一种能燃烧的单质,该气体是
H2
H2
(填化学式);
Ⅲ、硫酸铜晶体(CuSO
4?xH
2O)中结晶水(xH
2O)含量的测定
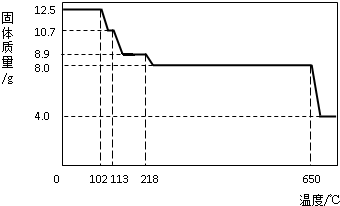
在老师的指导下,学习小组取12.5g硫酸铜晶体(CuSO
4?xH
2O)进行热分解,获得相关数据,并绘制成固体质量-温度的关系如下图.
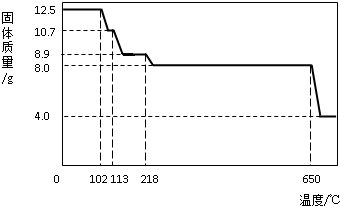
(1)在加热过程中,随着水分的蒸发,固体颜色将由蓝色逐渐变为
白
白
色,最终变为黑色;
(2)写出固体质量由10.7g变为8.9g时的化学方程式
;
(3)650℃以上时,硫酸铜固体就会发生分解,生成黑色金属氧化物、二氧化硫及氧气,此反应的化学方程式为
;
(4)根据图中数据,计算CuSO
4?xH
2O中的CuSO
4的质量分数.(要求:根据x的值进行计算,CuSO
4的相对分子质量:160,H
2O的相对分子质量:18)

 硫酸铜是生产、生活中常见的物质,下面是某学习小组展开的探究实录:
硫酸铜是生产、生活中常见的物质,下面是某学习小组展开的探究实录:
 硫酸铜是生产、生活中常见的物质,下面是某学习小组展开的探究实录:
硫酸铜是生产、生活中常见的物质,下面是某学习小组展开的探究实录: