
题目列表(包括答案和解析)
 某无色气体,用排水法收集满后,放在桌面上,如图所示.这说明该气体具有的物理性质是
某无色气体,用排水法收集满后,放在桌面上,如图所示.这说明该气体具有的物理性质是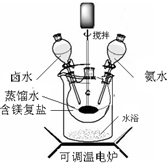 碱式碳酸镁密度小,是橡胶制品的优良填料.其组成一般以xMgCO3?yMg(OH)2?zH2O表示.
碱式碳酸镁密度小,是橡胶制品的优良填料.其组成一般以xMgCO3?yMg(OH)2?zH2O表示.| 实验操作 | 实验现象 | 实验结论 |
| ①取样溶解,向样品溶液中滴加过量稀硝酸. ②再向上述所得溶液加 硝酸银或AgNO3 硝酸银或AgNO3 溶液 |
现象① 产生气泡 产生气泡 ;现象② 产生白色沉淀 产生白色沉淀 ; |
含有 Cl- |
| ||
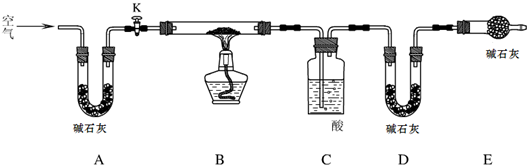
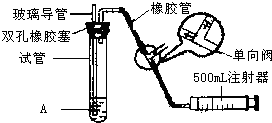 二氧化硫是大气污染物之一,为粗略地测定周围环境中的SO2含量,某学生课外活动小组设计了如图的实验装置.
二氧化硫是大气污染物之一,为粗略地测定周围环境中的SO2含量,某学生课外活动小组设计了如图的实验装置.| S02最高浓度限值(单位mg?m-3) | ||
| 一级标准 | 二级标准 | 三级标准 |
| 0.15 | 0.50 | 0.70 |
| 分组 | 第一小组 | 第二小组 |
| 抽气次数 | 120 | 140 |
| 空气中S02的含量(单位:mg?m-3) |
| 1 |
| 4 |
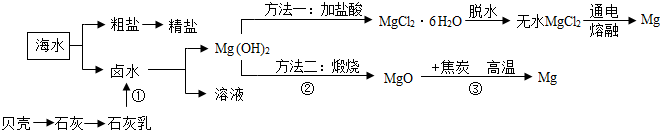
| 第一次 | 第二次 | 第三次 | |
| 所取样品的质量/g | 9 | 9 | 18 |
| 所用硫酸溶液质量/g | 60 | 80 | 50 |
| 生成氢气的质量/g | 0.6 | 0.6 | 0.6 |
| S02最高浓度限值 | ||
| 一级标准 | 二级标准 | 三级标准 |
| 0.15 | 0.50 | 0.70 |
| 分组 | 第一小组 | 第二小组 |
| 抽气次数 | 120 | 140 |
| 空气中S02的含量 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com