17、方海同学在学习“常见的碱”时,提出如下问题:
①检验少量二氧化碳为什么一般用澄清石灰水而不用NaOH溶液?
②实验时吸收较多的CO
2为什么一般用NaOH溶液而不用澄清石灰水?
[查阅资料]a.20℃时,熟石灰的溶解度为0.17g;b.熟石灰的溶解度随着温度升高而降低.
[实验探究]在教师指导下,方海同学进行了如下实验探究:
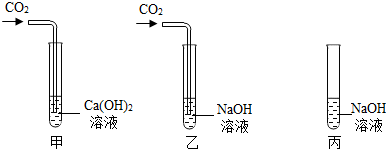
探究一、关于二氧化碳的检验
Ⅰ.在甲、乙、丙三支试管中加入等量NaOH或Ca(OH)
2 溶液(如下图),在甲、乙中分别通入少量CO
2.
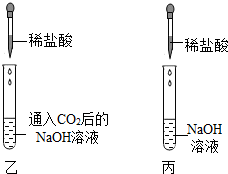
Ⅱ.在实验后的乙和丙两种澄清溶液中,分别滴入足量稀盐酸(如下图).

回答问题:
(1)Ⅰ中甲、乙二支试管的现象分别是
甲试管产生白色沉淀(或变浑浊),乙试管无明显现象
.
(2)Ⅱ中乙试管可观察到有气泡产生,写出该反应的化学方程式:
Na2CO3+2HCl═2NaCl+CO2↑+H2O
;设计丙试管实验的目的是
用作乙试管的对比实验,证明乙试管中CO2与NaOH发生了化学反应
.
[得出结论]检验少量CO
2一般用石灰水而不用NaOH溶液.
探究二、关于二氧化碳的吸收
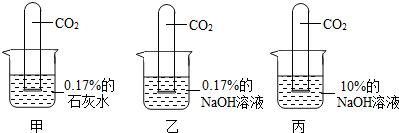
Ⅲ.进行如下图所示实验:
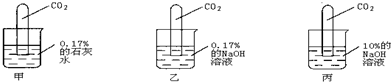
[实验现象]甲试管:液面上升最少; 乙试管:液面上升较甲略高;
丙试管:倒吸接近完全,仅在管底留有一小气泡.
(3)小刚认为,可直接配制10%的石灰水代替甲中0.17%的石灰水,与丙进行对比实验.你同意小刚的观点吗?答:
不同意
(填“同意”或“不同意”),理由是
20℃时,熟石灰的溶解度是0.17g,无法配制出10%的石灰水(或20℃时0.17%的石灰水是饱和溶液,石灰水的溶质质量分数不可能达到10%;其他合理答案也给分)
(4)比较乙、丙中进入试管内液体体积,得出的结论是
NaOH溶液的溶质质量分数越大,吸收CO2能力越强
.
[得出结论]实验时吸收CO
2选用较浓的NaOH溶液而不用Ca(OH)
2溶液的理由是
吸收时要尽量除尽CO2,NaOH极易溶于水,形成的溶液浓度大,吸收量多,效益高,而Ca(OH)2微溶,用它来吸收CO2要配大量溶液
.
[实验拓展]为了直观地观察到CO
2与NaOH反应后的现象,再利用右图装置进行实验.随着NaOH溶液的滴入,可观察到的现象是
小气球逐渐胀大
.