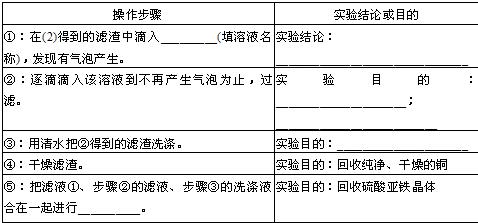
(2012?锦州)铝、铁、铜是我们生活中常见的金属.
(1)铝制品具有很好的耐腐蚀性能,原因是
铝易与氧气反应,在其表面形成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化
铝易与氧气反应,在其表面形成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化
.
(2)铁生锈的条件是
与氧气和水(或水蒸气)接触
与氧气和水(或水蒸气)接触
,生活中防止铁生锈的方法有
涂油(或镀其他金属、刷漆等其他防锈方法)
涂油(或镀其他金属、刷漆等其他防锈方法)
(写一种即可).
(3)高炉中以赤铁矿(主要成分氧化铁)为原料炼铁的原理是
(用化学方程式表示).
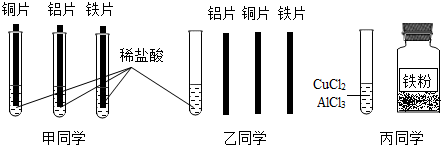
(4)为探究铝、铁、铜三种金属的活动性顺序,甲、乙、丙三位同学设计了如下实验方案(金属片已打磨),如图所示:
①甲同学根据铜片表面无变化的现象,判断出三种金属的活动性顺序为Al>Fe>Cu.
②乙同学只用一支试管,取一次稀盐酸也能证明Al>Fe>Cu.他在稀盐酸中插入金属的顺序为:
Fe、Cu、Al(或Cu.Fe、Al)(名称也可)
Fe、Cu、Al(或Cu.Fe、Al)(名称也可)
或
Cu、Fe、Al(或Fe、Cu、Al)(名称也可)
Cu、Fe、Al(或Fe、Cu、Al)(名称也可)
,写出其中一个反应的化学方程式
Fe+2HCl=FeCl2+H2↑(或3FeCl2+2A1=2AlCl3+3Fe)
Fe+2HCl=FeCl2+H2↑(或3FeCl2+2A1=2AlCl3+3Fe)
.
③丙同学把一定量的铁粉放入CuCl
2和AlCl
3的混合溶液中,充分反应后过滤,向滤出的固体中加入稀盐酸,无明显现象,则滤液中一定含有的溶质是
FeCl2、AlCl3(或氯化亚铁、氯化铝)
FeCl2、AlCl3(或氯化亚铁、氯化铝)
.