如图是启普发生器的简易装置,用图示的装置制取氢气,在塑料隔板上放粗锌粒,漏斗和带支管的试管中装有稀硫酸,若打开弹簧夹,则酸液由漏斗流下,试管中液面上升与锌粒接触,发生反应,产生的氢气由支管导出;若关闭弹簧夹,则试管中液面下降,漏斗中液面上升,酸液与锌粒接触,反应自行停止.需要时再打开弹簧夹,又可以使氢气发生.这是一种仅适用于室温下随制随停的气体发生装置.
回答下列问题:
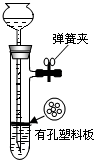
(1)这种制气装置在加入反应物前,应怎样检查装置的气密性?
弹簧夹,然后向长颈漏斗中加入水至形成一段水柱为止,静置,水柱高度不变,则装置不漏气
弹簧夹,然后向长颈漏斗中加入水至形成一段水柱为止,静置,水柱高度不变,则装置不漏气
(2)实验室可用如图所示的装置制取硫化氢气体,在塑料隔板上放硫化亚铁(FeS),漏斗中加入稀硫酸,写出制取硫化氢气体的化学方程式:
FeS+H2SO4═FeSO4+H2S↑
FeS+H2SO4═FeSO4+H2S↑
,硫化氢的水溶液叫氢硫酸,是一种二元弱酸,该酸与适量氢氧化钠溶液反应能生成正盐或酸式盐,分别写出这两个化学方程式:
H2S+2NaOH═Na2S+2H20
H2S+2NaOH═Na2S+2H20
2H2S+2NaOH═2NaHS+H2O
2H2S+2NaOH═2NaHS+H2O
(3)实验室用铜片和稀硝酸共热制取NO气体:
3Cu+8HNO
33Cu(NO
3)
2+2NO↑+4H
2O
该实验不能使用如图所示随制随停的制气装置,其原因是
反应需要加热
反应需要加热
.
(4)过氧化氢(H
2O
2)是一种无色粘稠液体,它的水溶液俗称双氧水.实验室可用双氧水和二氧化锰制取氧气:2H
2O
22H
2O+O
2↑
该实验不能使用如图所示随制随停的制气装置,其原因是
二氧化锰为粉末状的固体,所以不能放置于有孔的塑料板上
二氧化锰为粉末状的固体,所以不能放置于有孔的塑料板上
,正确的随制随停的制气装置应为(将装置图画在方框内).






