
题目列表(包括答案和解析)
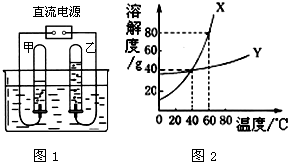 水是重要的自然资源,在进行化学实验和溶液中都需要水.请按要求回答下列问题:
水是重要的自然资源,在进行化学实验和溶液中都需要水.请按要求回答下列问题:| 感官指标 | 化学指标 | 细菌指标 |
| 水质无色无味澄清 | PH:6.5~8.5 | 细菌总个数<100个/mL等 |
 水是重要的自然资源,在进行化学实验和溶液中都需要水.请按要求回答下列问题:
水是重要的自然资源,在进行化学实验和溶液中都需要水.请按要求回答下列问题:| 感官指标 | 化学指标 | 细菌指标 |
| 水质无色无味澄清 | PH:6.5~8.5 | 细菌总个数<100个/mL等 |
多彩的“碳”,多姿的生活,让我们一起走进“碳”的世界.
(1)下列含碳元素的物质中,属于有机物的是 (填字母序号)。
A.碳酸钙 B.乙醇(C2H5OH) C.二氧化碳
(2)化石燃料主要包括煤、 和天然气,他们都含有碳元素,其中天然气的主要成分是 (写化学式)。含碳物质的燃烧会导致过多的二氧化碳排放,加剧了“温室效应”,写出一条减少二氧化碳排放的建议 。
(3)2013年3月,浙江大学实验室里诞生了世界上最轻的材料——“碳海绵”。(如图所示),由碳元素组成,具有多孔结构,弹性好。它对石油有很强的吸附能力(不吸水),将吸入的石油挤出后仍可恢复原状。下列关于碳海绵的说法正确的是 (填字母序号)。
A.具有吸附性 B.可重复利用 C.可处理海上石油泄漏
(4)液态二氧化碳灭火器可用于扑救档案资料室发生的火灾,下列说法正确的有 (填标号)。
A.液态二氧化碳气化后不会污染档案资料
B.二氧化碳可覆盖在燃烧物表面,隔绝空气
C.液态二氧化碳气化时吸热,降低了可燃物的着火点
(5)二氧化碳是很重要的化工原料,科学家设想利用太阳能加热器“捕捉CO2”、“释放CO2”,实现碳循环。
①步骤1的化学方程式为 。
②为确定步骤2中的碳酸钙是否完全分解,设计的实验步骤为:取少量固体于试管中,滴加过量 溶液,若观察到试管内 。则分解不完全。
③上述设想的优点有 (填字母序号)。
a.原料易得且可循环利用 b.充分利用太阳能 c.可全地域全天候使用
④CO2是宝贵的碳氧资源。CO2和H2在一定条件下可合成甲酸(HCOOH),此反应中CO2与H2的分子个数比为 ,若要检验1%甲酸水溶液是否显酸性,能选用的有 (填字母序号)。
a.无色酚酞溶液 b.紫色石蕊溶液 c.pH试纸
(6)小刚同学对碳及其重要化合物知识进行归纳、整理,并建构了如图所示的转化关系图。请回答下列问题:
(1)写出括号内一种含有碳元素物质的化学式 ;
(2)转化关系图中由H2CO3→CO2的反应类型是 反应;
(3)CO2常用于灭火,但镁着火不能用 CO2灭火,原因是它们能发生反应生成另一种氧化物和单质,请写出该置换反应的化学方程式 。



 硫酸铜是生产、生活中常见的物质,下面是某学习小组展开的探究实录:
硫酸铜是生产、生活中常见的物质,下面是某学习小组展开的探究实录:| Al片(未打磨) | Al片(打磨) | |
| CuSO4溶液 (5%,5mL) | 无变化,数小时后铝片上附有极少气泡,几乎无红色物质 | 极少气泡,附着极少红色物质,持续较长时间 |
| CuSO4溶液 (10%,5mL) | 无变化,数小时后铝片附有稍多气泡,仅有极少红色斑点 | 稍多气泡,附着极少(多于5%)红色物质,持续较长时间 |
| CuCl2溶液 (5%,5mL) | 多量气泡,迅速出现红色物质,很快溶液变成无色,且温度升高 | 更多量气泡,迅速出现红色物质,很快溶液变成无色,且温度升高 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com