
题目列表(包括答案和解析)
| 步骤 | 现象 | 结论或化学方程式 |
| 1、取少量药品放入水中,充分搅拌后过滤,在滤液里滴加酚酞 | 酚酞变红 | 写出氧化钙和水反应的化学方程式 CaO+H2O═Ca(OH)2 . |
| 2、在过滤后的滤渣中,滴加盐酸 | 有气泡生成 | 写出生成气体的有关化学方程式: CaCO3+2HCl═CaCl2+H2O+CO2↑ 生石灰 是 (填“是”或“没有”)变质 |
 (2012?怀柔区一模)A-E分别是由一种到三种元素组成的初中常见的5种固体物质,按要求回答相应的问题:
(2012?怀柔区一模)A-E分别是由一种到三种元素组成的初中常见的5种固体物质,按要求回答相应的问题:
| ||
| ||
| ||
| ||
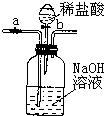 19、如图所示,装置a为弹簧夹,b为分液漏斗的活塞(通过开、关活塞可以随时滴加液体).先关闭b,打开a,将混有少量CO的CO2气体由左侧导管通入,充分反应后,排出的气体主要是
19、如图所示,装置a为弹簧夹,b为分液漏斗的活塞(通过开、关活塞可以随时滴加液体).先关闭b,打开a,将混有少量CO的CO2气体由左侧导管通入,充分反应后,排出的气体主要是
| ||
| ||
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com