某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.
【产品与原理】该厂采用“侯氏制碱法”生产化工产品--纯碱(Na
2CO
3)和化肥NH
4Cl.生产原理是:将NH
3和CO
2通入饱和食盐水中得到NaHCO
3和NH
4Cl的混合物,反应的化学方程式为:
(1分);分离出NaHCO
3,加热制得纯碱.
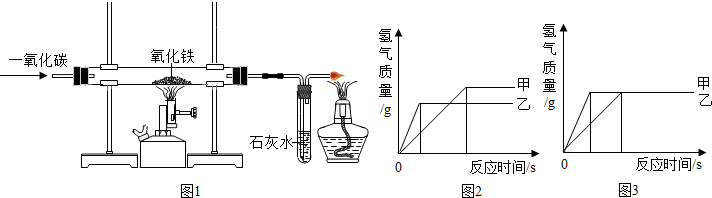
【生产流程】如图1
【相关资料】
(1)NH
4Cl
NH
3↑+HCl↑
(2)已知20℃时有关物质的溶解度如表(气体指1体积水中能溶解的气体体积)
| 物质 |
NaCl |
NaHCO3 |
NH4Cl |
NH3 |
CO2 |
| 溶解度 |
36.0g |
9.6g |
37.2g |
710 |
0.9 |
【问题讨论】(1)操作Ⅰ、Ⅱ、Ⅲ中,相同操作的名称为
.
(2)反应①中发生了两个反应,写出这两个化学方程式:①
;②
.
(3)反应③中得到纯碱的化学方程式为:
.
(4)溶液B中的溶质有
(至少写出两种).
(5)上述生产流程中可循环使用的是
(填序号).
A.挥发性气体C B.溶液D C.氢氧化镁 D.化肥NH
4Cl
(6)检验挥发性气体C的方法
.
【组成确定】
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO
3,再滴加AgNO
3溶液,有白色沉淀. 由上述实验可确定纯碱样品含有杂质
(写化学式).
【综合确定】
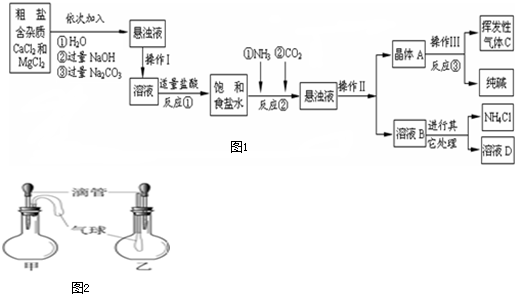
(1)如图2所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大.则滴管和烧瓶中所用试剂可能是:
A.甲:稀硫酸和铜片;乙:水和CO
2 B.甲:水和NH
4NO
3;乙:双氧水和MnO
2 C.甲:水和NH
3;乙:硝酸银溶液和HCl D.甲:CaCO
3固体和稀盐酸;乙:NaOH溶液和SO
2(2)小明同学把12gNaOH固体等分成A、B、C三份并采用不同方法保存.几天后,A未变质、B部分变质、C全部变质,他将三份固体分别配成溶液并滴入10%的稀硫酸直到正好反应.下列说法正确的是
A.几天后,三份固体的质量由小到大的顺序为:A<B<C
B.为控制正好反应,A可用酚酞试液指示,B、C可滴加稀硫酸直到正好不冒气泡
C.正好反应时,消耗稀硫酸的质量由大到小的顺序为:A>B>C
D.正好反应时,生成硫酸钠的质量都相等,均为7.1g
(3)工业上用氨气(NH
3)制取硝酸(HNO
3),工业流程为:①4NH
3+5O
2=4NO+6H
2O ②2NO+O
2=2NO
2 ③3NO
2+H
2O=2HNO
3+NO,下列判断不正确的是
A.①反应中使用的催化剂需要经常更换 B.在每一步反应中N元素的化合价都发生了改变
C.制取硝酸过程中产生的NO可循环使用
D.为实现原子利用率为100%,可在②③中控制NO、O
2和H
2O分子个数比为4:3:2
(4)某学生为了验证铁、锌、铜三种金属的活动性顺序.设计了四种方案:①将Zn、Cu分别加入到FeSO
4溶液中 ②将Fe、Cu分别加入到ZnSO
4溶液中 ③将Zn分别加入到FeSO
4、CuSO
4溶液中 ④将Fe分别加入到ZnSO
4、CuSO
4溶液中.其中可行的是
A.①④B.①②C.②③D.③④