
题目列表(包括答案和解析)
解:氧气的质量是:34g+2g-34.4g=1.6g 1分
设反应的过氧化氢的质量为X
![]() 1分
1分
68 32
x 1.6g
![]() ……1分
……1分
![]()
=3.4g……1分
![]()
 锥形瓶及其中各物质的总质量、
锥形瓶及其中各物质的总质量、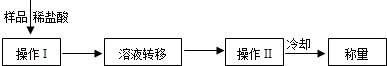
|
 锥形瓶及其中各物质的总质量、________.该方案有误差,请写出引起误差的一个原因:________.
锥形瓶及其中各物质的总质量、________.该方案有误差,请写出引起误差的一个原因:________.

分析:H2SO4和BaCl2反应生成BaSO4和HCl,再用NaOH中和剩余H2SO4时,不能忽视NaOH又和生成HCl发生反应的这个隐蔽反应,而且这个反应是解题时不走弯路的关键。
【常规解法】(l)设BaCl2消耗H2SO4的质量为x,反应生成HCl的质量为y
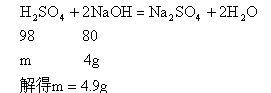 (2)设HCl消耗NaOH的质量为z
(2)设HCl消耗NaOH的质量为z
在反应中共消耗NaOH质量为32g×25%=8g,中和HCl用去4g,尚余4g
 (3)设4gNaOH中和的H2SO4质量为m
(3)设4gNaOH中和的H2SO4质量为m
硫酸中溶质的质量分数为
 答案:(略)
答案:(略)
【解法二】此题稍加分析,即可一步解出:用BaCl2的量不能求出H2SO4的量是因BaCl2不足量,而用NaOH的量却可求出H2SO4的量,因二者是完全中和的反应。之所以可用NaOH 而H+并未参加反应,而H+却恰好被NaOH中和完全,所以可据与NaOH的中和反应求H2SO4的量。
而H+并未参加反应,而H+却恰好被NaOH中和完全,所以可据与NaOH的中和反应求H2SO4的量。
设:H2SO4的量为x

硫酸中溶质的质量分数为 答案:(略)
答案:(略)
分析:天平平衡问题的计算一般指反应前天平已处于平衡,向托盘两边烧杯中加入物质后,引起烧杯内物质净增的变化量,从而确定天平能否再处于平衡。烧杯内物质净增质量=加入物质质量-放出气体质量,当左边净增质量=右边净增质量时,天平处于平衡;当左边净增质量>右边净增质量,天平指针会向左边偏转。
(1)当m1=m2=a时,要判断天平指是否偏转,关键要判断两边放出气体的质量是否相等。
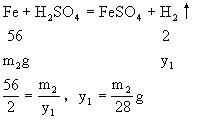
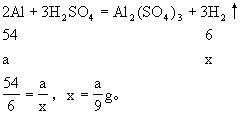 设ag铝片生成氢气质量为x,ag铁片生成氢气质量为y。
设ag铝片生成氢气质量为x,ag铁片生成氢气质量为y。

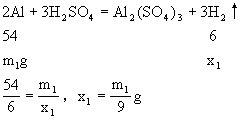 乙烧杯中物质的质量大,指针偏向乙烧杯。
乙烧杯中物质的质量大,指针偏向乙烧杯。
(2)若要指针不偏转,则要求甲、乙两烧杯中物质净增质量相等。设m1 g铝片生成氢气质量为x1,m1 g铁片生成氢气质量为y1。
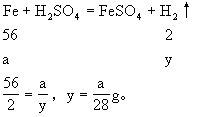
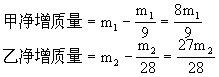
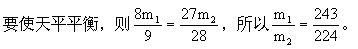 答:(1)偏乙;等质量的Al和Fe比较,Al反应产生的H2多些。 (2)243:224。
答:(1)偏乙;等质量的Al和Fe比较,Al反应产生的H2多些。 (2)243:224。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com