
题目列表(包括答案和解析)
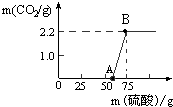 实验室有一瓶久置的NaOH,称取13.3g 的NaOH样品(杂质为Na2CO3)于烧杯中,然后向烧杯中逐滴加入质量分数19.6%的稀硫酸,反应情况如图所示.
实验室有一瓶久置的NaOH,称取13.3g 的NaOH样品(杂质为Na2CO3)于烧杯中,然后向烧杯中逐滴加入质量分数19.6%的稀硫酸,反应情况如图所示.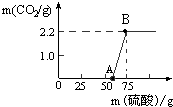 实验室有一瓶久置的NaOH,称取13.3g 的NaOH样品(杂质为Na2CO3)于烧杯中,然后向烧杯中逐滴加入质量分数19.6%的稀硫酸,反应情况如图所示.
实验室有一瓶久置的NaOH,称取13.3g 的NaOH样品(杂质为Na2CO3)于烧杯中,然后向烧杯中逐滴加入质量分数19.6%的稀硫酸,反应情况如图所示.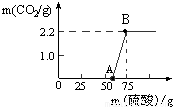
实验室有一瓶久置的NaOH,称取13.3g 的NaOH样品(杂质为Na2CO3)于烧杯中,然后向烧杯中逐滴加入质量分数19.6%的稀硫酸,反应情况如图所示。

(1)试计算:
①该样品中Na2CO3的质量为多少?
②B点所对应的溶液中溶质的质量分数为多少?
(2)从图中0~A点说明:在NaOH 与Na2CO3的混合溶液中,加入强酸,首先反应的物质是 ;②根据反应方程式分析,NaOH部分变质或全部变质,与没有变质的NaOH相比,中和反应时消耗强酸的量 (填“相等”、“不相等”或“无法确定”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com