
题目列表(包括答案和解析)

(1) 目前,我国火力发电厂燃料主要是煤。煤燃烧会排放出SO2和NO2,这些气体不仅污染空气,而且与空气中的物质反应后,生成的物质溶于雨水,会形成“酸雨”。请按要求回答下列问题:
①二氧化硫与空气中水份反应生成亚硫酸(H2SO3),亚硫酸易与氧气反应生成硫酸。其中亚硫酸与氧气的化学方程式是 。
②NO2是一种红棕色气体。在盛有NO2的集气瓶中放入一块活性炭,过一会儿,瓶内红棕色变淡甚至消失,活性炭具有的这种性质叫做 。
③对于SO2和NO2,小余同学归纳出了如下一些共同点,其中正确的是
A. 都是非金属氧化物 B.硫元素和氮元素化合价都为+2价
C.每个分子都由3个原子构成 D.常温常压下都是有颜色的气体
(2)五.一节放假结束后,小王来到实验室,发现一瓶氢氧化钠固体敞放着,这引起了她的研究欲望。
【提出问题】氢氧化钠是否变质?若发生变质,其程度如何?
【查阅资料】碳酸钠水溶液显碱性,氯化钠、氯化钙水溶液显中性。
【进行试验】Ⅰ.取样品少许,加入稀盐酸有气泡产生;
Ⅱ. 取样品少许,加水溶解后,滴入酚酞显红色;
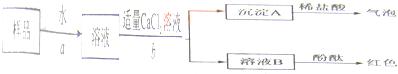
Ⅲ.按下图所示过程,进一步实验:

请你与小王同学一道完成下列问题的分析解答:
①氢氧化钠变质的化学反应方程式是 。
②完成步骤a、b实验,都要使用的两件玻璃仪器是 。
③步骤b中,不能用Ca(OH)2代替CaCl2的原因是——————————————————
④根据上述实验,若测定wg样品中氢氧化钠的质量分数,还须测定的数据是——
A.测定沉淀A 的质量
B.溶液B蒸发溶剂,测定残留固体的质量
C.溶液B与稀硫酸中和,测定消耗H2SO4的质量
| 温度 盐 溶解度 |
10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NH4HCO3 | 15.8 | 21.0 | 27.0 | ------ | ------ |
| NaHCO3 | 8.1 | 9.6 | 11.1 | 12.7 | ---- |
| NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
| 温度 盐 溶解度 |
10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NH4HCO3 | 15.8 | 21.0 | 27.0 | ------ | ------ |
| NaHCO3 | 8.1 | 9.6 | 11.1 | 12.7 | ---- |
| NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com