
题目列表(包括答案和解析)
⑴.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流。下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是 ▲ 。(可以多选)
A.用pH试纸测定Na2CO3溶液的pH
B.从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
C.实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
D.配制一定物质的量浓度的氯化钠溶液
E.取某溶液做焰色反应实验,说明该溶液中含有钠元素。
F.用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验。
G.促使过饱和的硝酸钾溶液析出晶体
H.用倾析法进行分离、洗涤颗粒较大的沉淀。
⑵.下列实验能达到实验目的且符合安全要求的是 ▲ 。(可以多选)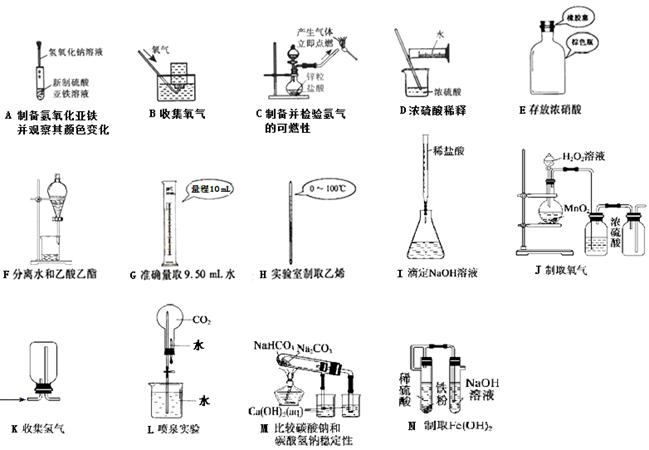
⑶.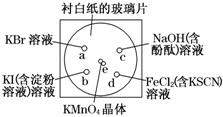 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol·L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体中滴加一滴浓盐酸,再立即将表面皿盖好。已知:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol·L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体中滴加一滴浓盐酸,再立即将表面皿盖好。已知:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
①.e处发生反应的离子方程式为 ▲ ,该反应中发生反应的氧化剂和还原剂的物质的量
之比为 ▲ 。
②.b处的实验现象为 ▲ ,d处的实验现象为 ▲ 。
③.c处反应的化学方程式为 ▲ ,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,
转移电子的物质的量为 ▲ mol。
④.通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱? ▲ (填“能”或
“不能”),若能,其氧化性由强到弱的顺序是 ▲ 。
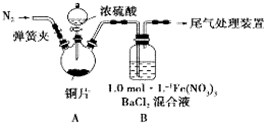
安徽省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,汽油中的硫含量下降三分之二,对二氧化硫的排放有了大大的改善,SO2可以用Fe( NO3)3溶液吸收,某化学兴趣小组对SO2和 Fe( NO3)3 溶液的反应[0.1mol/L的Fe(NO3)3 溶液的 pH=2]做了相应探究。
探究I
(1)某同学进行了下列实验:取12.8g铜片和20 mL 18 mol?L-1的浓硫酸放在三颈瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余,同时根据所学的知识同学们认为还有较多的硫酸剩余。

①配制1mol/L 的Fe(NO3)3溶液,需准确称量一定质量的Fe(NO3)3固体,在烧杯中溶解恢复到室温后,将溶液转移到容量瓶中,再经过洗涤、定容、摇匀可配得溶液,请回答将溶液转移至容量瓶中的操作方法________________________________。
②装置A中反应的化学方程式是_________________________________________。
③该同学设计求余酸的物质的量实验方案是测定产生气体的量。其方法有多种,请问下列方案中不可行的是______ (填字母)。
A.将产生的气体缓缓通过预先称量的盛有碱石灰的干燥管,结束反应后再次称重
B.将产生的气体缓缓通入足量Na2S溶液后,测量所得沉淀的质量
C.用排饱和NaHSO3溶液的方法测定其产生气体的体积(折算成标准状况)
探究II
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是____________________。
(3)装置B中产生了白色沉淀,分析B中产生白色沉淀的原因,提出下列三种猜想:
猜想1: SO2与Fe3+反应;
猜想2:在酸性条件下SO2与NO3-反应;
猜想3:____________________________________;
①按猜想1,装置B中反应的离子方程式是______________________________,证明该猜想1中生成的还原产物,某同学取少量溶液滴加几滴酸性高锰酸钾溶液,紫红色褪去,请分析该同学做法是否正确_________(填“正确”或“不正确”),理由是__________________________________。
②按猜想2,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列某种溶液,在相同条件下进行实验。应选择的替换溶液是______ (填序号)。
A.1 mol/L 稀硝酸
B.pH=1的FeCl3溶液?
C.6.0mol/L NaNO3和0.2 mol/L盐酸等体积混合的溶液
安徽省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,汽油中的硫含量下降三分之二,对二氧化硫的排放有了大大的改善,SO2可以用Fe( NO3)3溶液吸收,某化学兴趣小组对SO2和 Fe( NO3)3溶液的反应[0.1mol/L的Fe(NO3)3溶液的 pH=2]做了相应探究。
探究I
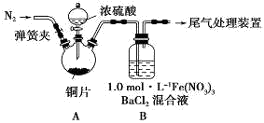
(1)某同学进行了下列实验:取12.8g铜片和20 mL 18 mol?L-1的浓硫酸放在三颈瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余,同时根据所学的知识同学们认为还有较多的硫酸剩余。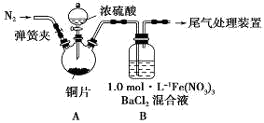
①配制1mol/L 的Fe(NO3)3溶液,需准确称量一定质量的Fe(NO3)3固体,在烧杯中溶解恢复到室温后,将溶液转移到容量瓶中,再经过洗涤、定容、摇匀可配得溶液,请回答将溶液转移至容量瓶中的操作方法________________________________。
②装置A中反应的化学方程式是_________________________________________。
③该同学设计求余酸的物质的量实验方案是测定产生气体的量。其方法有多种,请问下列方案中不可行的是______ (填字母)。
A.将产生的气体缓缓通过预先称量的盛有碱石灰的干燥管,结束反应后再次称重
B.将产生的气体缓缓通入足量Na2S溶液后,测量所得沉淀的质量
C.用排饱和NaHSO3溶液的方法测定其产生气体的体积(折算成标准状况)
探究II
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是____________________。
(3)装置B中产生了白色沉淀,分析B中产生白色沉淀的原因,提出下列三种猜想:
猜想1: SO2与Fe3+反应;
猜想2:在酸性条件下SO2与NO3-反应;
猜想3:____________________________________;
①按猜想1,装置B中反应的离子方程式是______________________________,证明该猜想1中生成的还原产物,某同学取少量溶液滴加几滴酸性高锰酸钾溶液,紫红色褪去,请分析该同学做法是否正确_________(填“正确”或“不正确”),理由是__________________________________。
②按猜想2,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列某种溶液,在相同条件下进行实验。应选择的替换溶液是______ (填序号)。
A.1 mol/L 稀硝酸
B.pH=1的FeCl3溶液
C.6.0mol/L NaNO3和0.2 mol/L盐酸等体积混合的溶液
 我省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,汽油中的硫含量下降三分之二,对二氧化硫的排放有了大大的改善,SO2可以用Fe( NO3)3溶液吸收,某化学兴趣小组对SO2和 Fe( NO3)3 溶液的反应[0.1mol/L的Fe(NO3)3 溶液的 pH=2]做了相应探究.
我省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,汽油中的硫含量下降三分之二,对二氧化硫的排放有了大大的改善,SO2可以用Fe( NO3)3溶液吸收,某化学兴趣小组对SO2和 Fe( NO3)3 溶液的反应[0.1mol/L的Fe(NO3)3 溶液的 pH=2]做了相应探究.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com