
题目列表(包括答案和解析)
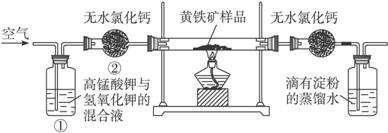
实验时有如下操作:
A.将磁管中样品加热到800—850 ℃。
B.称取研细的黄铁矿样品。
C.连接好全部仪器,并检查其气密性。
D.将样品小心放入硬质磁管中部。
E.以均恒的速度不断鼓入空气。
F.用标准碘溶液滴定含淀粉的SO2水溶液。
(1)正确的实验步骤的次序是(以A、B……的序号表示)_______________。
(2)装置①的作用是_______________;装置②的作用是_______________。
(3)碘跟SO2水溶液反应的离子方程式是_____________________________________。
(4)根据______________________________现象判断滴定已达到终点。
(5)有同学认为用上述装置测出的黄铁矿中硫元素的质量分数通常将偏低,你是否同意该观点_______________(填“是”或“否”),请说出你的主要理由_______________________。
(6)假定矿样中的硫全部转化为SO2,并全部被水吸收。若称得矿样的质量为0.090 0 g,滴定管中碘溶液的初读数为1.10 mL,末读数为25.60 mL,标准碘溶液的浓度为0.050 0 mol·L-1,则该黄铁矿样品中硫元素的质量分数为_______________。
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要 成分为FeS2)进行硫元素含量测定的实验探究及工业生产硫酸的探究。
I .将m1,g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置 省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2 + 11O2  2Fe2O3
+ 8SO2
2Fe2O3
+ 8SO2
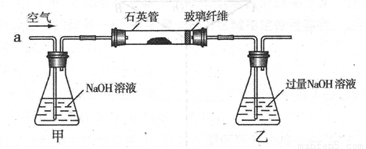
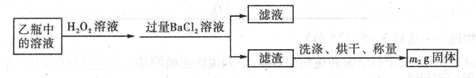
II反应结束后,将乙瓶中的溶液进行如下处理
(1)I中,乙瓶内发生反应的离子方程式有____________、__________。
(2)II中,所加H2O2溶液需足量的理由是____________________________
(3)该黄铁矿石中硫元素的质量分数为____________________________
(4)简述在催化反应室中设置热交换器的目的:______________。
(5)工业生产中常用氨——硫酸法进行尾气脱硫,以达到消除污染、废物利用的目的,用 两个化学方程式表示其反应原理_______________、______________
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要 成分为FeS2)进行硫元素含量测定的实验探究及工业生产硫酸的探究。
I .将m1,g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置 省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2 + 11O2 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2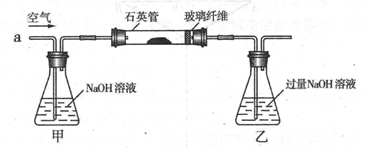
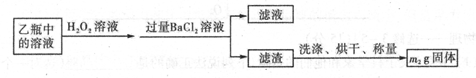
II反应结束后,将乙瓶中的溶液进行如下处理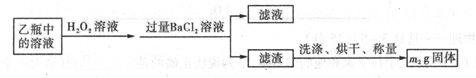
(1)I中,乙瓶内发生反应的离子方程式有____________、__________。
(2)II中,所加H2O2溶液需足量的理由是____________________________
(3)该黄铁矿石中硫元素的质量分数为____________________________
(4)简述在催化反应室中设置热交换器的目的:______________。
(5)工业生产中常用氨——硫酸法进行尾气脱硫,以达到消除污染、废物利用的目的,用 两个化学方程式表示其反应原理_______________、______________
 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:4FeS2+11O2 8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。
8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8 ℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)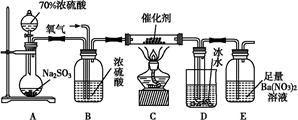
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是 。
②实验过程中,需要通入氧气。试写出一个用如图所示装置制取氧气的化学方程式 。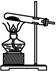
③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是 。
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如图装置验证二氧化硫的化学性质。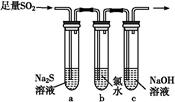
①能说明二氧化硫具有氧化性的实验现象为 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是 (填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为 。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com