
题目列表(包括答案和解析)
| ||
| ||
合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。
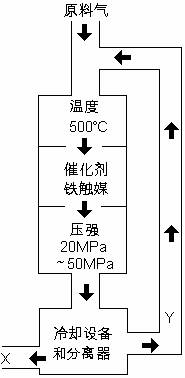
(1)X的化学式为____________;
(2)图中条件选定的主要原因是(选填字母序号)_________
A.温度、压强对化学平衡影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
(3)改变反应条件,会使平衡发生移动。下图表示随条件改变,氨气的百分含量的变化趋势。
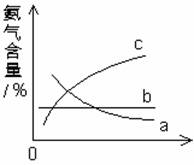
当横坐标为压强时,变化趋势正确的是(选填字母序号)____________,当横坐标为温度时,变化趋势正确的是(选填字母)__________。
(4)常温下氨气极易溶于水,其水溶液可以导电。
①用化学方程式表示氨气溶于水的过程中存在的可逆反应___________________。
②氨水中水电离出的c (OH―)__________10―7mol/L(填“>”、“<”或“=”)。
(5)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B两种物质。A为铵盐,B在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3mol A。写出氨气和氟气反应的化学方程式__________________________________
合成氨工业对化学工业和国防工业具有重要意义。
(1)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆过程
_______________________________________________________________
②氨水中水电离出的![]() (填写“>”、“<”或“=”)
(填写“>”、“<”或“=”)
③将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小依次为__________________。
(2)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B。A为铵盐,B在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3molA。
①写出氨气和氟气反应的化学方程式___________________________;
②在标准状况下,每生成1mol B,转移电子的物质的量为_________mol。
(3)I 在某压强恒定的密闭容器中加入2mol N2和4 mol H2,发生如下反应:
N2(g)+3H2 (g)![]() NH3(g)
NH3(g)![]()
达到平衡时,体积为反应前的三分之二。求:
①达到平衡时,N2的转化率为_________。
②若向该容器中加入amol N2、b mol H2、c mol NH3,且a、b、c均>0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。试比较反应放出的能量:
①_________②(填“>”、“<”或“=”)。
Ⅱ 若将2 mol N2和4 mol H2放入起始体积相同的恒容容器中,在与I相同的温度下达到平衡。
③试比较平衡时NH3的浓度I_________Ⅱ (填“>”、“<”或“=”)。
合成氨工业对化学工业和国防工业具有重要意义。设在容积为2.0 L的密闭容器中充入0.80 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的体积分数为20%。
![]() (1) 该条件下反应2NH3(g)
(1) 该条件下反应2NH3(g)![]() N2(g)+ 3H2(g)的平衡常数为 。
N2(g)+ 3H2(g)的平衡常数为 。
![]() (2)相同条件下,在另一相同容器中充入a mol N2(g)和b mo1 H2(g),达到平衡时,测得容器中NH3为0.8 mol,H2为2.0 mol,则
(2)相同条件下,在另一相同容器中充入a mol N2(g)和b mo1 H2(g),达到平衡时,测得容器中NH3为0.8 mol,H2为2.0 mol,则![]() 。
。
![]() (3)工业上可利用CH4(g)+H2O(g)
(3)工业上可利用CH4(g)+H2O(g)![]() CO(g)+3H2(g)反应生产合成氨原料气H2。已知温度、压强和水碳比[
CO(g)+3H2(g)反应生产合成氨原料气H2。已知温度、压强和水碳比[![]() ]对甲烷蒸汽转化反应的影响如下图:
]对甲烷蒸汽转化反应的影响如下图:
![]()
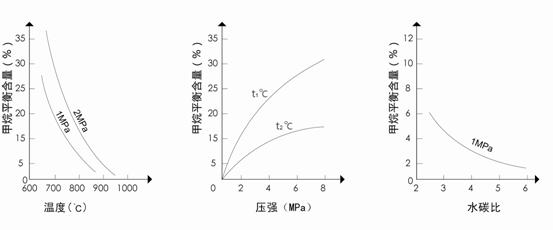
![]() 图1(水碳比为3) 图2(水碳比为3) 图3(800℃)
图1(水碳比为3) 图2(水碳比为3) 图3(800℃)
![]()
![]()
![]() ①降低反应的水碳比平衡常数K__________(选填“增大”、“减小”或“不变”);
①降低反应的水碳比平衡常数K__________(选填“增大”、“减小”或“不变”);![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 升高温度,平衡向____________方向移动(选正反应或逆反应)。
升高温度,平衡向____________方向移动(选正反应或逆反应)。
![]() ②图2中,两条曲线所示温度的关系是:t1_____t2(选填>、=或<);
②图2中,两条曲线所示温度的关系是:t1_____t2(选填>、=或<);
![]() 图1中,在800℃、2MPa比1MPa时的甲烷含量_______(选填高、低或不变),
图1中,在800℃、2MPa比1MPa时的甲烷含量_______(选填高、低或不变),
![]()
![]()
![]()
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com