
题目列表(包括答案和解析)
H![]() CaC2O4↓(白色)+2H2O
CaC2O4↓(白色)+2H2O
为探究乙二酸晶体(H

回答下列问题:
(1)乙二酸晶体(H
(2)a处试剂的名称是________________,反应一段时间后a处的现象为____________。
(3)足量澄清石灰水的作用是________________。
装置乙不能缺少,理由是_________________。
(4)丙中b处逸出的气体可能是________________。检验的方法是_______________(用化学方程式表示)。
(5)简述检查上述装置气密性的方法:__________________。
(6)乙二酸还可能具有的性质是_________________。(填序号)
A.能与银氨溶液发生银镜反应 B.能使酸性KMnO4溶液褪色
C.能与Na2CO3反应生成CO2 D.能使蓝墨水褪色
H![]() CaC2O4↓(白色)+2H2O
CaC2O4↓(白色)+2H2O
为探究乙二酸晶体(H

回答下列问题:
(1)乙二酸晶体(H
(2)a处试剂的名称是______________,反应一段时间后a处的现象为__________________。
(3)足量澄清石灰水的作用是____________________________________。
装置乙不能缺少,理由是________________________________________________。
(4)丙中b处逸出的气体可能是___________。检验的方法是___________(用化学方程式表示)。
(5)简述检查上述装置气密性的方法:____________________________________________。
(6)乙二酸还可能具有的性质是______________________。(填序号)
A.能与银氨溶液发生银镜反应
B.能使酸性KMnO4溶液褪色
C.能与Na2CO3反应生成CO2
D.能使蓝墨水褪色
已知乙二酸(HOOC―COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。某校研究性学习小组为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为_________________________________________。
(2)向盛有少量乙二酸饱和溶液的试管中滴入用硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有_________________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
____ MnO4– + ____ H2C2O4 + _____ H+ = _____ Mn2+ + _____ CO2↑ + _____ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):
实验发现,装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红,
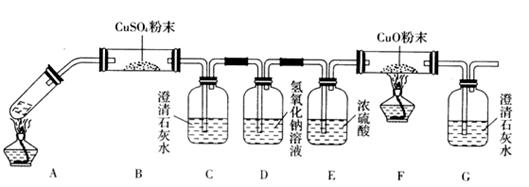
据此,乙二酸分解的产物为___________________________。上述装置中,D的作用是_____
__________________________________________。装置F中发生反应的化学方程式为:
___________________________________________________________。
(4)该小组同学将2.52 g草酸晶体(H2C2O4??2H2O)加入到100 mL 0.2 mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是______________________
________________________________________________________________。
已知乙二酸(HOOC―COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。某校研究性学习小组为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为_________________________________________________。
(2)向盛有少量乙二酸饱和溶液的试管中滴入用硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有_________________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
____ MnO4– + ____ H2C2O4 + _____ H+ = _____ Mn2+ + _____ CO2↑ + _____ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):
实验发现,装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红,
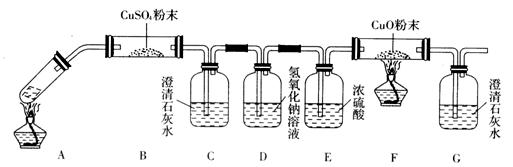
据此,乙二酸分解的产物为______________________。上述装置中,D的作用是______。装置F中发生反应的化学方程式为: _________________________________________。
(4)该小组同学将2.52g草酸晶体(H2C2O4??2H2O)加入到100 mL 0.2 mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是_________________________________。
已知乙二酸(HOOC―COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。某校研究性学习小组为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为_________________________________________。
(2)向盛有少量乙二酸饱和溶液的试管中滴入用硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有_________________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
____ MnO4– + ____ H2C2O4 + _____ H+ = _____ Mn2+ + _____ CO2↑ + _____ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):
实验发现,装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红,
据此,乙二酸分解的产物为___________________________。上述装置中,D的作用是_____
__________________________________________。装置F中发生反应的化学方程式为:
___________________________________________________________。
(4)该小组同学将2.52 g草酸晶体(H2C2O4•2H2O)加入到100 mL 0.2 mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是______________________
________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com