
题目列表(包括答案和解析)
铁广泛应用于工业生产和其他领域,它是目前最主要的一种金属材料。已知不同价态的铁元素之间能相互转化,转化关系如下图1所示:
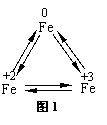 |
(1)写出工业上以赤铁矿(主要成分为Fe2O3)为原料炼铁的化学方程式 ,这个反应实现了 的转化。
(2)FeCl2易被空气中的氧气氧化成FeCl3。所以在配制FeCl2溶液时,常常向溶液中加入少量铁粉,使被氧气氧化产生的FeCl3重新转化为FeCl2。请根据上述信息写出FeCl3重新转化为FeCl2的化学方程式__________ 。
(3)图2表示的是一种医疗上用来治疗贫血的药品—硫酸亚铁片的说明书。
 |
计算FeSO4·7H2O的相对分子质量_________。药片表面的糖衣可以起到________作用。
(4)FeCl3能腐蚀铜,工业上常用此原理制作印刷线路板。图3是印刷线路板的制作及废液的处理过程:

其中滤渣的成分有__________,步骤③中发生反应的化学方程式有_______________ _;该流程中可以回收利用的物质有__________________。
金属及金属材料在生产生活中应用十分广泛。请回答以下问题:
(1)下列厨房用品所使用的主要材料,不属于金属材料的是________(填字母序号)。
 |  |  | |||
A.不锈钢高压锅 B.陶瓷罐 C.铜火锅
(2)人类有多种从自然界中提取金属的方法。其中我国是世界上最早采用湿法冶金提取铜的国家,请写出铁与硫酸铜溶液反应制取铜的化学方程式_______ _。并求算用这种方法制取铜,11.67t含杂质4%的生铁完全反应,在理论上可以换取 t铜。
(3)金属钠性质很活泼,只能以化合物的形式存在于自然界,其中氯化钠就是一种常见且很重要的含钠化合物。氯化钠的用途十分广泛,化工生产中经常采用电解熔融氯化钠的方法制取金属钠(也就是在通电条件下使融化的氯化钠分解),试写出该反应的化学方程式
(注:该反应的另一种产物是由双原子分子构成的气态物质)。工业生产还可以通过电解食盐水的方法制取烧碱,与此同时产生的氢气和氯气可以合成其它重要的化工产品。请运用“化学语言”描述工业上用氯化钠制取烧碱的过程。 。


铝、铜和铁及化合物在生产、生活中广泛使用。
(1)工业上用一氧化碳和赤铁矿(主要成分是氧化铁)冶炼铁,反应的化学方程式为___ _。
(2)每年世界上钢铁的产量很高,钢铁的锈蚀也给人类带来了巨大的损失。铁在空气中锈蚀,实际上是铁跟空气中的 和 共同作用的结果。为了防止钢铁锈蚀,人们常采用在其表面涂刷矿物油或镀上其他金属等覆盖保护膜的方法。这些方法都能防止锈蚀的共同原理是 。
 (3)铜表面也容易生成绿色铜锈,铜锈的主要成分是碱式碳酸铜,化学式为Cu2(OH)2CO3,其组成元素有___ __种。老师用生锈的铜片、铁粉和稀硫酸进行实验,实验过程如下图所示(部分生成物已略去)。
(3)铜表面也容易生成绿色铜锈,铜锈的主要成分是碱式碳酸铜,化学式为Cu2(OH)2CO3,其组成元素有___ __种。老师用生锈的铜片、铁粉和稀硫酸进行实验,实验过程如下图所示(部分生成物已略去)。
①紫红色固体C的化学式为___ __;从溶液B中分离出固体C的操作是 。
②写出II中反应的化学方程式___ __。
③试推测无色气体A为___ __。(填名称)
(4)小善同学查阅资料得知,防止木质文物变形的常用方法![]() 是:将明矾结晶在木质纤维间隙中。受资料启发,他在家里尝试做明矾的结晶实验,具体做法及现象如图7。
是:将明矾结晶在木质纤维间隙中。受资料启发,他在家里尝试做明矾的结晶实验,具体做法及现象如图7。
以上实验可推断:在一定量的水中,明矾的溶解限量随温度的升高而 ;(填“增大”或“减小”)
明矾晶体析![]() 出后剩余的溶液是 溶液。(填“饱和”或“不饱和”)
出后剩余的溶液是 溶液。(填“饱和”或“不饱和”)
 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com