
题目列表(包括答案和解析)
X、Y、Z、W均为含有10电子的微粒,W为金属阳离子,X、Y、Z常温下为气体,
(1)已知: W + X + H2O → 白色沉淀。
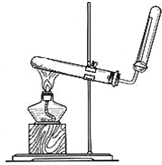
①若实验室用下图所示装置、干燥和收集装置制取并收集干燥的X,A中分液漏斗中的液态试剂的仪器的名称是________,仪器的连接顺序为a→________________________;
②由W离子形成的可溶性盐WCln,其水溶液显_________性,原因是(用离子方程式表示)_____________________________________________________
③为进一步确定W,进行如下实验,请补全实验操作、现象和结论:取上述白色沉淀少量置于试管中,_____________________________________________________
(2)常温下,取10 mL pH= a的Y的稀溶液,加水稀释时pH随溶液体积V的变化如图所示,则①Y的化学式为__________。
②下列有关Y的叙述正确的是__________
A.Y溶于水后部分发生电离
B.Y的水溶液中滴加石蕊试液会变红
C.稀释后溶液中所有离子的浓度均减小
D.稀释后,阴离子的物质的量浓度之和不变
③一定量X溶液和一定量的Y的溶液混合,所得溶液中离子浓度的等式关系为:
(用实际离子符号表示)
(3)已知H2的燃烧热为285.8 kJ·mol-1。现有Z和H2 的混合气体共0.2 mol,与O2完全燃烧生成H2O(l)和CO2(g),转移电子的物质的量为1.0 mol,放出的热量为117.6 kJ。写出Z完全燃烧的热化学反应方程式__________________________________
X、Y、Z、W均为含有10电子的微粒,W为金属阳离子,X、Y、Z常温下为气体,
(1)已知: W + X + H2O → 白色沉淀。
①若实验室用下图所示装置、干燥和收集装置制取并收集干燥的X,A中分液漏斗中的液态试剂的仪器的名称是________,仪器的连接顺序为a→________________________;
②由W离子形成的可溶性盐WCln,其水溶液显_________性,原因是(用离子方程式表示)_____________________________________________________
③为进一步确定W,进行如下实验,请补全实验操作、现象和结论:取上述白色沉淀少量置于试管中,_____________________________________________________
(2)常温下,取10 mLpH= a的Y的稀溶液,加水稀释时pH随溶液体积V的变化如图所示,则①Y的化学式为__________。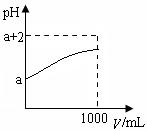
②下列有关Y的叙述正确的是__________
| A.Y溶于水后部分发生电离 |
| B.Y的水溶液中滴加石蕊试液会变红 |
| C.稀释后溶液中所有离子的浓度均减小 |
| D.稀释后,阴离子的物质的量浓度之和不变 |
X、Y、Z、W均为含有10电子的微粒,W为金属阳离子,X、Y、Z常温下为气体,
(1)已知: W + X + H2O → 白色沉淀。
①若实验室用下图所示装置、干燥和收集装置制取并收集干燥的X,A中分液漏斗中的液态试剂的仪器的名称是________,仪器的连接顺序为a→________________________;

②由W离子形成的可溶性盐WCln,其水溶液显_________性,原因是(用离子方程式表示)_____________________________________________________
③为进一步确定W,进行如下实验,请补全实验操作、现象和结论:取上述白色沉淀少量置于试管中,_____________________________________________________
(2)常温下,取10 mL pH= a的Y的稀溶液,加水稀释时pH随溶液体积V的变化如图所示,则①Y的化学式为__________。
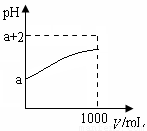
②下列有关Y的叙述正确的是__________
A.Y溶于水后部分发生电离
B.Y的水溶液中滴加石蕊试液会变红
C.稀释后溶液中所有离子的浓度均减小
D.稀释后,阴离子的物质的量浓度之和不变
③一定量X溶液和一定量的Y的溶液混合,所得溶液中离子浓度的等式关系为:
(用实际离子符号表示)
(3)已知H2的燃烧热为285.8 kJ·mol-1。现有Z和H2 的混合气体共0.2 mol,与O2完全燃烧生成H2O(l)和CO2(g),转移电子的物质的量为1.0 mol,放出的热量为117.6 kJ。写出Z完全燃烧的热化学反应方程式__________________________________


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com