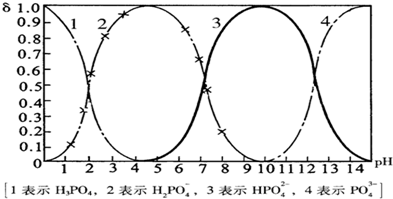
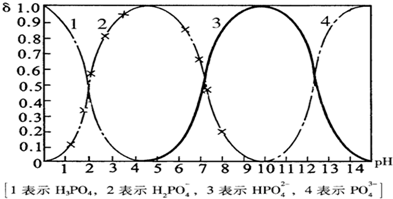
磷酸(H
3PO
4)在溶液中能够以H
3PO
4、H
2PO
4-、HPO
42-、和PO
43-四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化.下图是H
3PO
4溶液中,各种粒子的物质的量分数δ随pH的变化曲线:
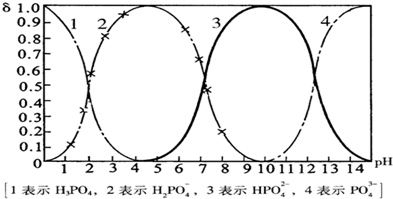
(1)设磷酸总浓度为c(总),写出c(总)与各粒子浓度间的关系式
c(总)=c(H3PO4)+c(H2PO4-)+c(HPO42-)+c(PO43-)
c(总)=c(H3PO4)+c(H2PO4-)+c(HPO42-)+c(PO43-)
.
(2)向Na
3PO
4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为
HPO42-+H+═H2PO4-
HPO42-+H+═H2PO4-
.当pH=7时,溶液中主要存在的阴离子(OH
-离子除外)是
H2PO4-、HPO42-
H2PO4-、HPO42-
.
(3)从图中推断NaH
2PO
4溶液呈
酸
酸
性(填“酸”、“碱”、或“中”),其原因是
H2PO4-在溶液中的电离程度大于水解程度
H2PO4-在溶液中的电离程度大于水解程度
.
(4)在Na
3PO
4溶液中,c(Na
+)/c(PO
43-)
>
>
3(填“>”、“═”、或“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na
+)/c(PO
43-)的值减小,原因是
KOH抑制了PO43-的水解
KOH抑制了PO43-的水解
.