
题目列表(包括答案和解析)
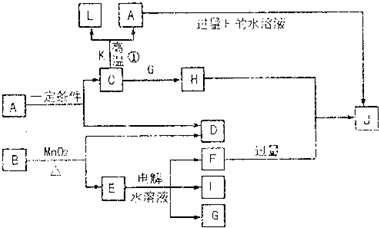

请填空:?
(1)D的元素与I的元素能形成原子个数比为1∶1的共价化合物,其电子式为 。?
(2)写出用石墨作电极,电解E水溶液的离子方程式 。气体G在 极逸出(填“阳”或“阴”)。?
(3)写出C+K→L+A的化学方程式 ,指出引发此反应的方法: 。
(4)写出A+F→J的离子方程式 。?
[化学选修-物质结构与性质](13分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)A的氢化物的分子空间构型是 ,其中心原子采取 杂化,属于 (填“极性分子”和“非极性分子”)。
(3)F和M(质子数为25)两元素的部分电离能数据列于下表:
| 元 素 | M | F | |
| 电离能 (kJ·mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 |
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难。对此,你的解释是 ;
(4)晶体熔点:DC EC(填“<、=、>”),原因是 。
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
|
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因 ?
(6)已知某化合反应,在反应过程中只有σ键的断裂与生成,写出符合要求的化学方程式
(写一个)。
[化学选修-物质结构与性质](13分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)A的氢化物的分子空间构型是 ,其中心原子采取 杂化,属于 (填“极性分子”和“非极性分子”)。
(3)F和M(质子数为25)两元素的部分电离能数据列于下表:
|
元 素 |
M |
F |
|
|
电离能 (kJ·mol-1) |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难。对此,你的解释是 ;
(4)晶体熔点:DC EC(填“<、=、>”),原因是 。
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
|
|
熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
|
H2S |
187 |
202 |
2.6 |
|
H2C2 |
272 |
423 |
以任意比互溶 |
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因 ?
(6)已知某化合反应,在反应过程中只有σ键的断裂与生成,写出符合要求的化学方程式
(写一个)。
已知A、B为常见的金属单质,C、D为常见的非金属单质,甲、乙、丙为三种常见的化合物,甲是中学化学中常见的红棕色粉末状固体,它们之间的相互转化关系如图所示(部分产物及反应条件没有列出):
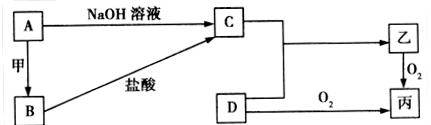
(1)写出框图中A转化为B的化学方程式:_______________________________________,该反应属于______________(填“吸热反应”或“放热反应”)。
(2)若乙的水溶液呈弱酸性,丙是一种大气污染物、有刺激性气味。已知16 g固体单质D完全燃烧转化成丙时,放出148.4 kJ的热量,则该反应的热化学方程式为:
_____________________________________________________________________________。
(3)若乙在水溶液中呈弱碱性,其盐可用作化肥,且C与D化合生成乙的反应是可逆反应。
①将等物质的量的C、D两种单质充入一体积恒定的密闭容器中,在适当催化剂和恒温条件下反应,下列说法中不正确的是____________(填字母)。
a.达到化学平衡时,2υ正(C) = 3υ逆(乙)
b.反应过程中,D单质的体积分数始终为50%
c.达到化学平衡时,混合气体的密度保持不变
d.达到化学平衡的过程中,气体的平均相对分子质量逐渐增大
e.达到化学平衡后,再升高温度,乙的体积分数增大
②若在一个体积为10 L的密闭容器中,充入8 mol C单质和2 mol D单质,在一定温度下发生反应生成气体乙,经40 min后反应达到平衡,此时C的转化率为37.5%。从反应开始到达平衡的40 min内,用物质乙表示的化学反应速率为_________________________;达到平衡后,若向容器中按5∶1∶2的物质的量之比再次充入C、D、乙三种物质,则原平衡体系中C的转化率将_____________(填“增大”、“减小”或“不变”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com