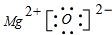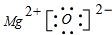A、B、C、D都是短周期中的元素,A元素的离子焰色反应呈黄色;B原子核内质子数和中子数相等,B元素的离子和Ne具有相同的电子层结构;2.4g B单质恰好与100ml 2mol/L的盐酸完全反应;H
2在C单质中燃烧产生苍白火焰;D元素原子的最外层电子数是次外层电子数的3倍.根据上述条件,回答:
(1)A是
Na
Na
元素,B是
Mg
Mg
元素,D是
O
O
元素.四种元素中金属性最强的是
Na
Na
(填写元素符号),B和D形成的化合物的电子式为
.
(2)元素C位于第
三
三
周期
ⅤⅡA
ⅤⅡA
族,它的最高价氧化物对应水化物的化学式为
HClO4
HClO4
.
(3)A与D的单质在加热条件下形成化合物的化学式为
Na2O2
Na2O2
该化合物中含有的化学键类型为
离子键、非极性共价键
离子键、非极性共价键
(填“离子键”“极性共价键”或“非极性共价键”).
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为
Cl2 +2OH-=Cl-+ClO-+H2O
Cl2 +2OH-=Cl-+ClO-+H2O
.