
题目列表(包括答案和解析)
酸、碱、盐是有广泛用途的重要化合物。某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动。
(1)盐酸、硫酸等具有相似的化学性质,是因为二者的水溶液中都含有 离子。打开盛浓盐酸和浓硫酸的试剂瓶的瓶盖,立即就能把它们区分开来,这是因为 。
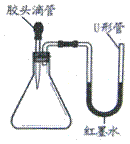
(2)右图是甲同学设计的趣味实验装置,其气密性良好。若胶头滴管中的物质是浓NaOH溶液,锥形瓶中充满CO2,则挤压胶头滴管后能观察到什么现象?并写出有关反应的化学方程式。
(3)盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末。乙同学和丙同学对这种白色粉末的成分进行了如下猜想和验证。
(Ⅰ)可能是NaOH(Ⅱ)可能是Na2CO3 (Ⅲ)可能是NaOH与Na2CO3的混合物
①乙同学向所取少量粉末中滴加一种溶液后,排除了(Ⅰ)的可能性。请你推测他所加的试剂和观察到的现象。
②丙同学提议用酚酞试液来鉴定,你认为可行吗?请简要说明理由。
(4)某同学对附近一家化工厂排放的污水中的氢氧化钠含量进行了测定。他取了40g污水于烧杯中,逐滴加入5%的稀盐酸中和,当恰好完全反应时,用去稀盐酸7.3g。请计算废水中氢氧化钠的质量分数。
酸、碱、盐是有广泛用途的重要化合物。某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动。
(1)盐酸、硫酸等具有相似的化学性质,是因为二者的水溶液中都含有 离子。打开盛浓盐酸和浓硫酸的试剂瓶的瓶盖,立即就能把它们区分开来,这是因为 。
(2)右图是甲同学设计的趣味实验装置,其气密性良好。若胶头滴管中的物质是浓NaOH溶液,锥形瓶中充满CO2,则挤压胶头滴管后能观察到什么现象?并写出有关反应的化学方程式。
(3)盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末。乙同学和丙同学对这种白色粉末的成分进行了如下猜想和验证。
(Ⅰ)可能是NaOH(Ⅱ)可能是Na2CO3 (Ⅲ)可能是NaOH与Na2CO3的混合物
①乙同学向所取少量粉末中滴加一种溶液后,排除了(Ⅰ)的可能性。请你推测他所加的试剂和观察到的现象。
②丙同学提议用酚酞试液来鉴定,你认为可行吗?请简要说明理由。
(4)某同学对附近一家化工厂排放的污水中的氢氧化钠含量进行了测定。他取了40g污水于烧杯中,逐滴加入5%的稀盐酸中和,当恰好完全反应时,用去稀盐酸7.3g。请计算废水中氢氧化钠的质量分数。
小亮同学想通过实验探究某企业采用的氨碱法制的的纯碱样品的成分及含量。
【提出问题】该纯碱样品中含有哪些物质?
【猜想与假设】通过分析,小亮做出如下假设:
(1)只含有Na2CO3 ; (2)含有Na2CO3和NaHCO3
【查阅资料】
| NaHCO3 | Na2CO3 | |
| 加入稀盐酸 | 现象Ⅰ | 产生气泡 |
| 加入饱和石灰水 | 溶液变浑浊 | 现象Ⅱ |
| 加入CaCl2溶液 | 无明显现象 | 溶液变浑浊 |
| 加热溶液至沸腾,将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 |
(1)表中的现象Ⅰ为 ;
(2)现象Ⅱ对应的化学方程式为 。
【实验探究】为了确定纯碱样品的成分,小亮设计如下实验方案,请你一起完成小列实验报告。
| 实验步骤 | 实验现象 | |
| ①取少量样品溶于水,加入过量的CaCl2溶液。 | ; | 该反应的方程式: 。 |
| ②将上述反应后的混合液过滤,取滤 。 | ; | 证明猜想②成立。 |
【实验反思】
实验步骤①中,氯化钙溶液过量的目的是 。
 【提出问题2】如何测量该纯碱样品中各物质的含量?
【提出问题2】如何测量该纯碱样品中各物质的含量?
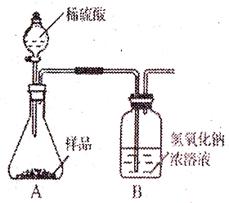
(1)为测量该纯碱样品各成分的含量,小亮设计了右图装置,通过称量B装置懂得质量变化来确定样品中各成分的含量。该装置气密性良好,稀硫酸与样品、进入装置B的CO2与NaOH均完全反应,操作无误,但多次实验发现,测定结果有偏差。造成偏差的原因有① ;
② 。
(2)小亮在老师的指导下重新设计了如下的实验装置。该实验有以下操作步骤:
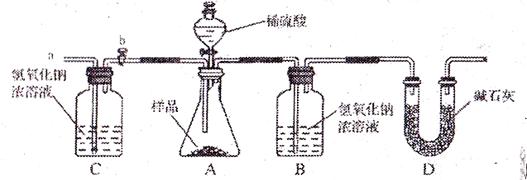
①检查装置气密性,将w g 干燥的样品放入锥形瓶中;
②称量盛有氢氧化钠浓溶液的B瓶质量;
③打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
④向锥形瓶中逐滴加入稀硫酸至不再产生气泡
⑤再次称量盛有氢氧化钠浓溶液的B瓶质量;
⑥打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
⑦根据B瓶增加的质量,计算样品中各成分的含量。
该实验的正确步骤是 。
小亮同学想通过实验探究某企业采用的氨碱法制的的纯碱样品的成分及含量。
【提出问题】该纯碱样品中含有哪些物质?
【猜想与假设】通过分析,小亮做出如下假设:
(1)只含有Na2CO3 ; (2)含有Na2CO3和NaHCO3
【查阅资料】
|
|
NaHCO3 |
Na2CO3 |
|
加入稀盐酸 |
现象Ⅰ |
产生气泡 |
|
加入饱和石灰水 |
溶液变浑浊 |
现象Ⅱ |
|
加入CaCl2溶液 |
无明显现象 |
溶液变浑浊 |
|
加热溶液至沸腾,将气体通入澄清石灰水 |
澄清石灰水变浑浊 |
澄清石灰水无明显变化 |
(1)表中的现象Ⅰ为 ;
(2)现象Ⅱ对应的化学方程式为 。
【实验探究】为了确定纯碱样品的成分,小亮设计如下实验方案,请你一起完成小列实验报告。
|
实验步骤 |
实验现象 |
|
|
①取少量样品溶于水,加入过量的CaCl2溶液。 |
; |
该反应的方程式: 。 |
|
②将上述反应后的混合液过滤,取滤液 。 |
; |
证明猜想②成立。 |
【实验反思】
实验步骤①中,氯化钙溶液过量的目的是 。
【提出问题2】如何测量该纯碱样品中各物质的含量?
(1)为测量该纯碱样品各成分的含量,小亮设计了下图装置,通过称量B装置懂得质量变化来确定样品中各成分的含量。该装置气密性良好,稀硫酸与样品、进入装置B的CO2与NaOH均完全反应,操作无误,但多次实验发现,测定结果有偏差。造成偏差的原因有
 ①
;
①
;
② 。
(2)小亮在老师的指导下重新设计了如下的实验装置。该实验有以下操作步骤:

①检查装置气密性,将w g 干燥的样品放入锥形瓶中;
②称量盛有氢氧化钠浓溶液的B瓶质量;
③打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
④向锥形瓶中逐滴加入稀硫酸至不再产生气泡
⑤再次称量盛有氢氧化钠浓溶液的B瓶质量;
⑥打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
⑦根据B瓶增加的质量,计算样品中各成分的含量。
该实验的正确步骤是 。
小亮同学想通过实验探究某企业采用的氨碱法制的的纯碱样品的成分及含量。
【提出问题】该纯碱样品中含有哪些物质?
【猜想与假设】通过分析,小亮做出如下假设:
(1)只含有Na2CO3 ; (2)含有Na2CO3和NaHCO3
【查阅资料】
| NaHCO3 | Na2CO3 | |
| 加入稀盐酸 | 现象Ⅰ | 产生气泡 |
| 加入饱和石灰水 | 溶液变浑浊 | 现象Ⅱ |
| 加入CaCl2溶液 | 无明显现象 | 溶液变浑浊 |
| 加热溶液至沸腾,将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 |
(1)表中的现象Ⅰ为 ;
(2)现象Ⅱ对应的化学方程式为 。
【实验探究】为了确定纯碱样品的成分,小亮设计如下实验方案,请你一起完成小列实验报告。
| 实验步骤 | 实验现象 | |
| ①取少量样品溶于水,加入过量的CaCl2溶液。 | ; | 该反应的方程式: 。 |
| ②将上述反应后的混合液过滤,取滤液 。 | ; | 证明猜想②成立。 |
【实验反思】
实验步骤①中,氯化钙溶液过量的目的是 。
 【提出问题2】如何测量该纯碱样品中各物质的含量?
【提出问题2】如何测量该纯碱样品中各物质的含量?
(1)为测量该纯碱样品各成分的含量,小亮设计了右图装置,通过称量B装置懂得质量变化来确定样品中各成分的含量。该装置气密性良好,稀硫酸与样品、进入装置B的CO2与NaOH均完全反应,操作无误,但多次实验发现,测定结果有偏差。造成偏差的原因有① ;
② 。
(2)小亮在老师的指导下重新设计了如下的实验装置。该实验有以下操作步骤:

①检查装置气密性,将w g 干燥的样品放入锥形瓶中;
②称量盛有氢氧化钠浓溶液的B瓶质量;
③打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
④向锥形瓶中逐滴加入稀硫酸至不再产生气泡
⑤再次称量盛有氢氧化钠浓溶液的B瓶质量;
⑥打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
⑦根据B瓶增加的质量,计算样品中各成分的含量。
该实验的正确步骤是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com