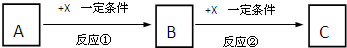
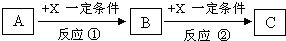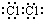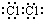A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去).
试回答:
(1)若X是强氧化性气体单质,则A可能是
ac
ac
(填序号).
a.C b.Al c.Na d.Mg
(2)若X是金属单质,向C的水溶液中滴加AgNO
3溶液,产生不溶于稀HNO
3的白色沉淀,X在A中燃烧产生棕黄色的烟.
①B的化学式为
FeCl3
FeCl3
;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程表示)
2Fe3++Fe=3Fe2+,防止Fe2+被氧化成Fe3+
2Fe3++Fe=3Fe2+,防止Fe2+被氧化成Fe3+
.
②向C的溶液中加入氢氧化钠溶液,现象是
产生白色沉淀,迅速变成灰绿色,最终变为红褐色沉淀
产生白色沉淀,迅速变成灰绿色,最终变为红褐色沉淀
,写出涉及到的氧化还原反应的化学方程
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
.
(3)若A、B、C均为含有同种金属元素的化合物,X是强酸或强碱,则B的化学式为
Al(OH)3
Al(OH)3
,反应②的离子方程式为
Al(OH)3+OH-=AlO2-+2H2O或Al(OH)3+3H+=Al3++3H2O
Al(OH)3+OH-=AlO2-+2H2O或Al(OH)3+3H+=Al3++3H2O
.