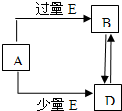
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
(1)若A和E为单质,组成A单质的元素是自然界中形成化合物种类最多的元素.
①B属于分子
非极性
非极性
(填“极性”或“非极性”),B分子中各原子最外层
是
是
(填“是”或“否”)都满足8电子结构;
②向50mL 4mol/L的NaOH溶液中通入1.12L B(标准状况),反应后溶液中溶质的物质的量之比为
n(Na2CO3):n(NaOH)═1:2
n(Na2CO3):n(NaOH)═1:2
(填化学式和物质的量之比);
③4g A单质完全燃烧放出131.2kJ的热量,写出表示A单质燃烧热的热化学方程式
C(s)+O2(g)=CO2(g);△H=-393.6kJ/mol
C(s)+O2(g)=CO2(g);△H=-393.6kJ/mol
.
(2)若A为第三周期中的元素所形成的氯化物.
①写出A溶液→B的离子方程式
Al3++4OH-=AlO2-+2H2O
Al3++4OH-=AlO2-+2H2O
;
②写出A和B的溶液反应的离子方程式
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.
(3)若A为常见的金属,在E的冷、浓溶液中,A有钝化现象.已知:X为含有非极键的离子化合物,且1mol X含有38mol电子,向D溶液中加入与D等物质的量的X固体,恰好完全反应,写出该反应的离子方程式
4Fe2++4Na2O2+6H2O=4Fe(OH)3+O2↑+8Na+
4Fe2++4Na2O2+6H2O=4Fe(OH)3+O2↑+8Na+
.

 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).下列说法错误的是( )
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).下列说法错误的是( ) 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去). 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).下列说法错误的是( )
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).下列说法错误的是( )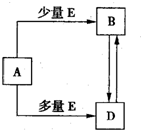 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).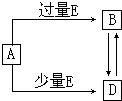 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).