A、B、C、D、E五种元素分属三个短周期,且原子序数依次增大.A、C同主族.A与B、A与C、A与E、B与C可按原子个数比1:1分别形成化合物甲、乙、丙、丁,B、D同主族,可形成DB
2、DB
3两种分子.
回答下列问题:
(1)B在元素周期表中的位置为
第二周期ⅥA族
第二周期ⅥA族
.
(2)化合物乙的电子式为
.
(3)B、E的单质及两元素之间形成的化合物中可作水消毒剂的有
O3、Cl2、ClO2等
O3、Cl2、ClO2等
(写出其中两种物质的化学式)).
(4)A
2D的燃烧热△H=-a kJ/mol,写出A
2D燃烧反应的热化学方程式:
2H2S+3O2=2SO2(g)+2H2O(l)△H=-2akJ/mol
2H2S+3O2=2SO2(g)+2H2O(l)△H=-2akJ/mol
.
(5)写出FeE
2与物质丁按物质的量之比2:1的反应的离子方程式:
6Fe2++3Na2O2+6H2O=4Fe(OH)3↓+2Fe3++6Na+
6Fe2++3Na2O2+6H2O=4Fe(OH)3↓+2Fe3++6Na+
.
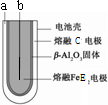
(6)熔融状态下,C的单质和FeE
2能组成可充电电池(装置示意图如下),反应原理为:2Z+FeE
2Fe+2ZE
放电时,电池的正极反应式为
Fe2++2e-=Fe
Fe2++2e-=Fe
.
以二甲醚(CH
3OCH
3)、空气、氢氧化钾溶液为原料,石墨为电极可构成一种性能优良的高效燃料电池.给上述电池充电,则与a电极相连的二甲醚电池电极上的反应式为
CH3OCH3+16OH--12e-=2CO32-+11H2O
CH3OCH3+16OH--12e-=2CO32-+11H2O
.


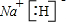
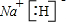
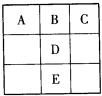 A、B、C、D、E五种元素在元素周期表中的位置如图所示:
A、B、C、D、E五种元素在元素周期表中的位置如图所示:
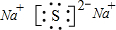
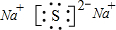
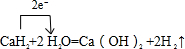
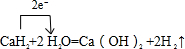
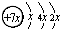 ,E的价层电子排布式为3d64s2.回答下列问题:
,E的价层电子排布式为3d64s2.回答下列问题: