
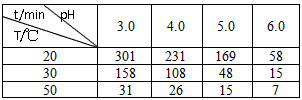
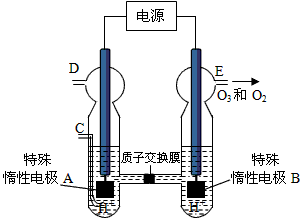
题目列表(包括答案和解析)
(10分)硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
[甲方案]:如右图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。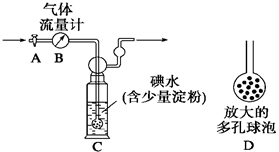
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是___________________________________。
(2)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量____________(填“偏高”、“偏低”或“无影响”)。
[乙方案]:实验步骤如下面流程图所示: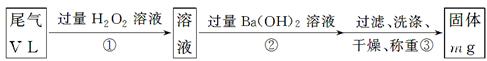
(3)步骤①中过量H2O2的作用是
(4)写出步骤②中反应的化学方程式__________________________________________
(5)步骤②中Ba(OH)2是否足量的判断方法是__________________________________
______________________________________________________________________。
(6)通过的尾气体积为V L(已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为_____________________________(用含有V、m的代数式表示)。
(10分)硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
[甲方案]:如右图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。

(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是___________________________________。
(2)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量____________(填“偏高”、“偏低”或“无影响”)。
[乙方案]:实验步骤如下面流程图所示:
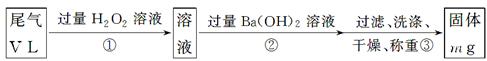
(3)步骤①中过量H2O2的作用是
(4)写出步骤②中反应的化学方程式__________________________________________
(5)步骤②中Ba(OH)2是否足量的判断方法是__________________________________
______________________________________________________________________。
(6)通过的尾气体积为V L(已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为_____________________________(用含有V、m的代数式表示)。
FeSO4•7H2O广泛用于医药和工业领域,以下是FeSO4•7H2O的实验室制备流程图。根据题意完成下列填空:
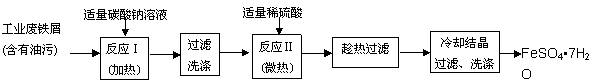

操作① 操作② ![]() 操作③ 操作④ 操作⑤
操作③ 操作④ 操作⑤
(1)操作①中碳酸钠溶液能除去油污,原因是 (用离子方程式表示)。
(2)下列物质分离方法的原理与过滤相同的是 (填序号字母)。
a.蒸馏 b.分液
c.渗析 d.重结晶
(3)FeSO4•7H2O是某些补血剂的主要成分,实验室中为测定某补血剂中铁元素的含量,进行了以下实验:①配制100mL1.00×10-2mol·L-1的KMnO4溶液,所用的仪器有天平、烧杯、胶头滴管及 。配制过程中下列说法中,正确的是 (填序号字母)。
a. KMnO4溶于水不放热,可以直接在容量瓶中溶解
b.容量瓶洗涤后不需干燥即可直接用于实验
c.定容后摇匀,凹液面低于刻度线,再加水至凹液面最低点与刻度线相平
d.如果定容时加水超过刻度线必须重新配制
②取2.0g克该补血剂配成溶液,进行预处理,使其中的铁元素全都是Fe2+,再用配制好的标准KMnO4溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+ = 5Fe3++Mn2++4H2O。进行滴定时,标准KMnO4溶液应该盛放在 (填“酸式”或“碱式”之一)滴定管中,原因是
。
③滴定结束时,消耗浓度为1.00×10-2mol·L-1的标准KMnO4溶液26.00mL,则该补血剂中铁元素的含量为 %。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com