
题目列表(包括答案和解析)
| 元素 | 有关信息 |
| X | 元素主要化合价-2,原子半径为0.0074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 单质在X的单质中燃烧,产物是造成酸雨的罪魁祸首之一 |
| D | 最高价氧化物对应的水化物能电离出电子数相等的阴、阳离子 |
| E | 单质是生活中的常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物对应的水化物,能按1:1电离出电子数相等的阴、阳离子 |
| E | 其单质有多种同素异形体,一种为自然界中硬度最大 |
有关元素X、Y、Z、D、E的信息如下:
| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm |
| Y | 所在主族序数与所在周期叙述之差为4 |
| Z | 原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物对应的水化物,能按1:1电力出电子数相等的阴、阳离子 |
| E | 其单质有多中同素异形体,一种为自然界中硬读最大 |
(1)画出Y的离子结构示意图_________________________;
(2)写出D的最高4氧化物的水化物电离出的阴离子的电子式_________;
(3)![]() 的溶液与Y的单质可能发生反应,其反应的离子方程式为__________;
的溶液与Y的单质可能发生反应,其反应的离子方程式为__________;
(4)用化学符号表示,![]() 的水溶液中各离子的浓度关系________(列等式);
的水溶液中各离子的浓度关系________(列等式);
 (5)已知
(5)已知![]() 与
与![]() 可发生反应
可发生反应
![]() ;当反应达到
;当反应达到
平衡时不断改变条件(不改变![]() 、
、![]() 、
、![]() 的量)反
的量)反
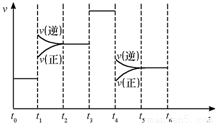
应速率随时间的变化如右图:其中表示平衡混合物中![]()
含量最高的一段时间是___________;如![]() 平衡常数为
平衡常数为
![]() 平衡常数为
平衡常数为![]() ,则
,则![]() ________
________![]() (填“大于”、
(填“大于”、
“等于”或“小于”)。
有关元素X、Y、Z、D、E的信息如下:
| 元素 | 有关信息 |
| X | 元素主要化合价-2,原子半径为0.0074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 单质在X的单质中燃烧,产物是造成酸雨的罪魁祸首之一 |
| D | 最高价氧化物对应的水化物能电离出电子数相等的阴、阳离子 |
| E | 单质是生活中的常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
请回答下列问题(用化学用语表示):
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为
。
(2)比较Y与Z的氢化物的稳定性 > (用化学式表示)。
(3)E元素与Y元素可形成EY2和EY3,两种化合物,则下列说法中正确的是 (填序号)
①通常实验室配制EY2溶液时,可直接用水溶解EY3固体
②EY2不能通过单质直接化合产生
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④Y、Z、D的离子半径大小依次减小
(4)Y的最高价氧化物为无色液体,当0.25mol该物质与一定量的水混合得到一种稀溶液时,放出![]() 的热量。写出该反应的热化学方程式 。
的热量。写出该反应的热化学方程式 。
(5)写出E在潮湿的空气中发生腐蚀时正极上的电极反应式 。
(6)氯碱工业上制取气体Y单质的反应时,当电路中通过![]() 电子时,阴阳两极共产生气体 L(标准状况)。
电子时,阴阳两极共产生气体 L(标准状况)。
有关元素X、Y、Z、D、E的信息如下:
| 有关信息 |
X | 元素主要化合价为-2,原子半径为0.074 nm |
Y | 所在主族序数与所在周期序数之差为4 |
Z | 原子半径为0.102 nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
D | 最高价氧化物对应的水化物可溶于水,且能电离出电子数相等的阴、阳离子 |
E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
请回答下列问题:
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为___________。
(2)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号)_______。
①保存EY2溶液时,需向溶液中加入少量E单质
②EY2只能通过置换反应生成,EY3只能通过化合反应生成
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
(3)将Z单质在X的单质中燃烧的产物和等物质的量的Y单质同时通入足量的水中,充分反应后的溶液中滴入品红溶液,现象是__________________,有关反应的离子方程式为________________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com