
题目列表(包括答案和解析)
[化学——选修物质结构与性质]
A、B、C、D为1~36号元素。A元素的原子价电子排带为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的p亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子。
(1)当n=2时,AB2属于_____分子(填“极性”或“非极性”),分子中有____个σ键,____个π键。
(2)当n=3时,A与B形成的晶体属于_____晶体。
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是___(用元素符号表示)。
(4)已知某红紫色配合物的组成为CoCl3·5NH3·H2O。该配合物中的中心离子钴离子在基态的核外电子排布式为____,作为配位体之一的NH3分子的空间构型为_____。
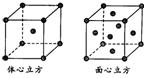
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为_____。
[化学——选修物质结构与性质](15分)
A、B、C、D为1~36号元素。A元素的原子价电子排带为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的p亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子。
(1)当n=2时,AB2属于_____分子(填“极性”或“非极性”),分子中有____个σ键,____个π键。
(2)当n=3时,A与B形成的晶体属于_____晶体。
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是___(用元素符号表示)。
(4)已知某红紫色配合物的组成为CoCl3·5NH3·H2O。该配合物中的中心离子钴离子在基态的核外电子排布式为____,作为配位体之一的NH3分子的空间构型为_____。
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为_____。
[化学——选修物质结构与性质](15分)
A、B、C、D为1~36号元素。A元素的原子价电子排带为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的p亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子。
(1)当n=2时,AB2属于_____分子(填“极性”或“非极性”),分子中有____个σ键,____个π键。
(2)当n=3时,A与B形成的晶体属于_____晶体。
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是___(用元素符号表示)。
(4)已知某红紫色配合物的组成为CoCl3·5NH3·H2O。该配合物中的中心离子钴离子在基态的核外电子排布式为____,作为配位体之一的NH3分子的空间构型为_____。
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为_____。

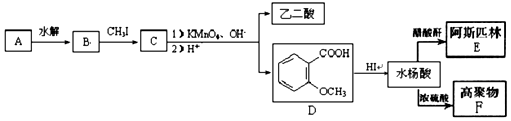
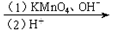 CH3CH2COOH+CH3COOH
CH3CH2COOH+CH3COOH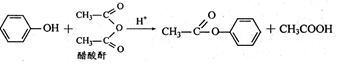
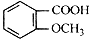 的同分异构体较多。其中属于酯,并且苯环上的一氯代物只有两种的同分异构体的结构简式为______________________苯环上只有两个取代基且处于邻位的同分异构体可以形成比较稳定的环酯,写出一种环酯的结构简式: ____________________。
的同分异构体较多。其中属于酯,并且苯环上的一氯代物只有两种的同分异构体的结构简式为______________________苯环上只有两个取代基且处于邻位的同分异构体可以形成比较稳定的环酯,写出一种环酯的结构简式: ____________________。 (12分)
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容,请选择其中一题,并在相应的答题区域作答。若两题都做,则按A题评分。
A.(12分)已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大。A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2—离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2。
 请回答下列问题:
请回答下列问题:
⑴A、B、C、D四种元素中,电负性最大的是 ▲ (填元素符号)。
⑵B的氢化物的沸点远高于A的氢化物的主要原因是 ▲ 。
 ⑶由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为 ▲ 。
⑶由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为 ▲ 。
⑷E2+离子能与AC分子形成[E(AC)4]2+,其原因是AC分子中含有 ▲ 。
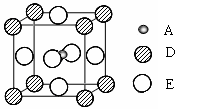
⑸最近发现,只含A、D、E三种元素的一种晶体(晶胞如右图所示)具有超导性。A原子的配位数为 ▲ ;该晶体的化学式为 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com