
题目列表(包括答案和解析)
(11分)已知某工业废水中含有CuCl2、FeCl2、HCl,某化学探究学习小组打算用这种废水制备纯净的FeCl2晶体。为此他们设计了如下的实验方案: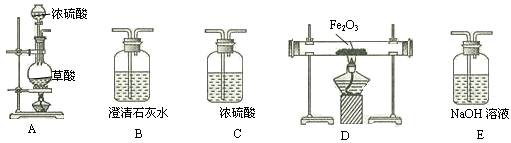
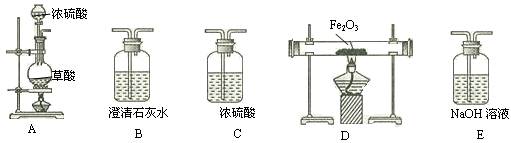
第一步:用上图中的仪器和药品组装一套实验装置制取干燥的CO,用CO还原Fe2O3粉末制取还原铁粉。提示:制取CO的原理为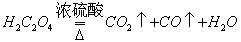 。
。
(1)如果所制气体流向从左向右时,上述组装的实验装置从左向右的实验装置连接顺序(填仪器序号)是 
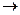 。
。
(2)正确的操作第一步应是 ;最后一步应是熄灭 处的酒精灯。
(3)装置B的作用是 ;装置E的作用是 。
(4)第二步:将制得的还原铁粉放入原混合溶液中,制得纯净的FeCl2溶液。
必须进行的操作是 。
(5)第三步:得到纯净的FeCl2晶体。
必须进行的操作是 。
已知某工业废水中含有CuCl2、FeCl2、HCl,某化学探究学习小组打算用这种废水制备纯净的FeCl2晶体。为此他们设计了如下的实验方案:

第一步:用上图中的仪器和药品组装一套实验装置制取干燥的CO,用CO还原Fe2O3粉末制取还原铁粉。提示:制取CO的原理为![]() 。
。
(1)如果所制气体流向从左向右时,上述组装的实验装置从左向右的实验装置连接顺序(填仪器序号)是 ![]()
![]()
![]()
![]() 。
。
(2)正确的操作第一步应是 ;最后一步应是熄灭 处的酒精灯。
(3)装置B的作用是 ;装置E的作用是 。
(4)第二步:将制得的还原铁粉放入原混合溶液中,制得纯净的FeCl2溶液。
必须进行的操作是 。
(5)第三步:得到纯净的FeCl2晶体。
必须进行的操作是 。
 。
。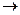
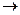
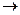
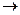 。
。
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
 Fe2+(aq)+3OH-(aq)
Fe2+(aq)+3OH-(aq) Fe2+(aq)+3OH-(aq)
Fe2+(aq)+3OH-(aq)| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com