
题目列表(包括答案和解析)
NaCl、KNO3两种物质的溶解度曲线如下图所示。
①t1℃氯化钠的溶解度 (27) 硝酸钾(填“>”或“<”或“=”);
 ②图中a点的含义是 (28) ;
②图中a点的含义是 (28) ;
③若硝酸钾中含有少量氯化钠,要提 纯硝酸钾可
纯硝酸钾可
采用 (29) 的方法。
④某兴趣小组做了如下实验。
【实验一】提纯NaCl
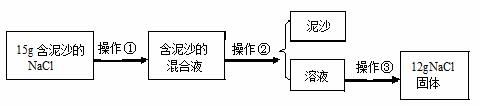
 请根据实验回答下列问题:
请根据实验回答下列问题:
Ⅰ.操作①、②、③依次为下图中的
(30) (填序号);
Ⅱ .若得到NaCl的产量比实际值偏低,则可能的原因是 (31) (填序号);
.若得到NaCl的产量比实际值偏低,则可能的原因是 (31) (填序号);
A.过滤时滤纸有破损,混合液流入滤液中
B.蒸发时受热不均匀,有晶体溅出
C.蒸发时,看到有晶体析出,立即停止加热
D.溶解15 g含有泥沙的NaCl样品时,加入的水量不足
Ⅲ.用上述实验所得纯净的氯化钠,配制5%的氯化钠溶液50 g,需要氯化钠 (32) g。
【实验 二】溶解和结晶
二】溶解和结晶
请根据硝酸钾的溶解度和相关实验,回答下列问题:
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 溶解度(g/100g水) | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 |
某兴趣小组做了以下实验:
 Ⅳ. 上述溶液中的溶质是 (33) ,上述实验过程中得到的溶液一定属于
Ⅳ. 上述溶液中的溶质是 (33) ,上述实验过程中得到的溶液一定属于
不饱和溶液的是 (34) (填数字序号),⑤所对应的实验现象是 (35) ;
实验过程中,溶液中溶质的质量分数一定相等的是 (36) (填数字序号)。
Ⅴ.为了防止水体污染,小组同学提出了如下方案处理实验后的废液:
步骤I:将⑤继续冷却至0℃,过滤,共可回收得到KNO3固体 (37) g ;
步骤II:将步骤Ⅰ中的滤液(忽略过滤中的损耗)稀释,可得到 (38) g溶质质量分数为1%的KNO3溶液,用做肥料。


有关溶液的计算
1.判断反应前后溶液质量的变化及变化量.
2.溶液中溶质质量分数的计算中,涉及溶液体积的计算.计算依据:溶液质量=溶液体积×________;溶液密度×________×________=溶质的质量
3.溶液稀释浓缩的相关计算
溶液增浓有三种方法:一种是补充________;一种是蒸发________;另一种是加入高浓度溶液.计算依据:稀释或浓缩前后溶质的质量相等.
4.有溶质的质量分数与化学方程式的综合计算
在根据化学方程式进行计算时,因为代入化学方程式的都是纯净物的质量,所以,如果是溶液,只能代入溶质,计算出的也是纯净物的质量.对于反应后所得溶液的质量有两种求法:
①溶液组成法:溶液质量=溶质质量+溶剂质量,其中溶质一定是被溶解的且没有与水发生反应,溶剂水通常有两种:A.原溶液中的水,B.化学反应新生成的水.
②质量守恒:溶液质量=进入液体的固体质量(包括由于反应进入和直接溶入的)+液体质量-________-________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com