
题目列表(包括答案和解析)
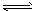 H2+I2
H2+I2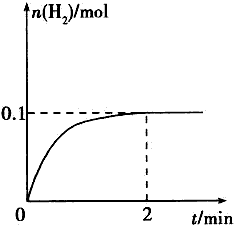
硫—碘循环分解水制氢主要涉及下列反应:
I SO2+2H2O+I2==H2SO4+2HI
II 2HI ![]() H2+I2
H2+I2
III 2H2SO4==2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应III易在常温下进行
b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1molO2的同时产生1 molH2
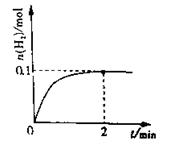
(2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示。0~2min内的平均反应速率v(HI)= 。该温度下,H2(g)+I2(g)![]() 2HI(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
2HI(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知 2H2(g)+O2(g)====2H2O(l) △H=-572kJ·mol-1
某氢氧燃料电池释放22.8kJ电能时,生成1mol液态水,该电池的能量转化率为 。
硫——碘循环分解水制氢主要涉及下列反应:
I SO2+2H2O+I2=H2SO4+2HI II 2HI ![]() H2+I2 III 2H2SO4=2SO2+O2+2H2O
H2+I2 III 2H2SO4=2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是
a.反应III易在常温下进行 b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2的同时产生1molH2
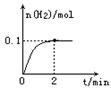 (2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应II ,H2物质的量随时间的变化如图所示。
(2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应II ,H2物质的量随时间的变化如图所示。
0—2min内的平均反应速率v(HI)= ;
该温度下,H2(g)+I2(g)![]() 2HI(g)的平衡常数K= 。
2HI(g)的平衡常数K= 。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b. HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的 ,产生H2的速率将增大。
A.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
硫—碘循环分解水制氢主要涉及下列反应:
I.SO2+2H2O+I2=H2SO4+2HI II. 2HI ![]() H2+I2 III. 2H2SO4=2SO2+O2+2H2O
H2+I2 III. 2H2SO4=2SO2+O2+2H2O
分析上述反应,下列判断正确的是:
A.循环过程中需补充H2O B.反应I中SO2氧化性比HI强
C.反应III易在常温下进行 D.循环过程中产生1molO2的同时产生1 molH2
(16分) 硫—碘循环分解水制氢主要涉及下列反应:
I SO2+2H2O+I2==H2SO4+2HI
II 2HI H2+I2
III 2H2SO4==2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应III易在常温下进行
b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1molO2的同时产生1 molH2
(2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示。0~2min内的平均反应速率v(HI)= 。该温度下,H2(g)+I2(g)2HI(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
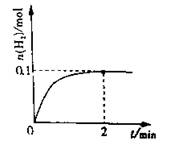
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知 2H2(g)+O2(g)====2H2O(l) △H=-572kJ·mol-1
某氢氧燃料电池释放22.8kJ电能时,生成1mol液态水,该电池的能量转化率为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com